Организация хромосом
Раздел, в котором исследуются закономерности наследственности и изменчивости на уровне клетки и субклеточных структур - хромосом.
Гетерохроматин
ДНК способна связываться с различными белками, образуя структуру называемую хроматином. Хроматин подразделяется на два функциональных состояния: эухроматин и гетерохроматин. Гетерохроматин разделяется на конститутивный - существующий постоянно в течении всего клеточного цикла и факультативный, образующийся в определенные моменты времени в определенных местах. К отличительным свойствам гетерохроматина относят: конденсированное состояние в интерфазе, транскрипционно неактивное состояние, поздняя репликация в S-фазе клеточного цикла ... Так же к особенностям гетерохроматина можно отнести недорепликацию в политенных хромосомах у дрозофилы.
Эухроматин обогащен следующими модификациями: ацетилирование H3 и H4, метилирование H4K20, H4K9 и H3K27.
Для гетерохроматина характерно метилирование H3K9, но эта модификация встречается также и в эухроматине, особенно в ORF.
Цитологическое строение гетерохроматина
Формирование гетерохроматина у Дрозофилы
Наиболее ранний этап формирования гетерохроматина (ГХ) происходит при участии механизма интерференции РНК, при котором sRNA (small RNAs) воздействуют на места будущего гетерохроматина посредством RITS комплекса (см. обзор РНК интерференция).
На следующей стадии происходит замена гистона H2A гистоном H2Av, что запускает процессы ацетилирования H4K12 и деацетилирование H3K9 (см. обзор Гистоны). Деацетилированный Н3K9 метилируется ферментом Su(var)3-9.
К модифицированному таким образом гистону присоединяется HP1 (heterochromatin protein 1), способствующий присоединению гистон метилтрансферазы Suv4-20, триметилирующей гистон H4K20.
Таким образом образование гетерохроматина проходит по следующей схеме
замена H2A на H2Av--> действие RITS-комплекса--> ацетилирование H4K12 --> деацетилирование и метелирование H3K9 --> связывание Me-H3K9 белка HP1 --> метилирование H4K20.
Формирование гетерохроматина у дрожжей
У Sp наблюдается классический эффект положения гена (см. обзор Эффект положения гена) в пределах центромер, теломер и локуса ответственного за определение пола, что говорит о наличии гетерохроматина. Необходимо отметить, что хромосомы дрожжей, в отличие от политенных хромосом дрозофилы, не видны в световой микроскоп, поэтому выявить гетерохроматиновые участки можно только косвенным путем.
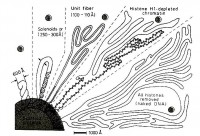
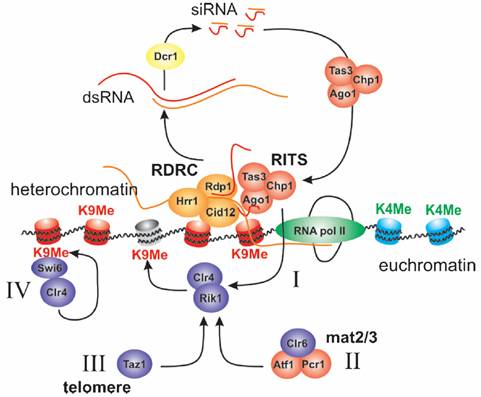 рис.1 Механизмы, способствующие образованию гетерохроматина в различных местах.
рис.1 Механизмы, способствующие образованию гетерохроматина в различных местах.
Образованию гетерохроматина предшествует метилирование H3K9 с последующим присоединением HP1 (Swi6). Конвергентные промоторы в пределах повторов центромерной ДНК образуют dsRNA, которые Dcr1 превращает в siRNA. siRNA связываются с RITS и атакуют образующиеся в промоторах транскрипты, связываясь с ними через комплиментарные взаимодействия. RITS и RDRC комплексы объединяются, увеличивая действие сигнала и стабилизируя процесс. Такой RNAi зависимый процесс основной в установлении метилирования H3K9 (механизм I). Локус ответственный за определение пола определяется HDAC связывания через белки связывающие ДНК (механизм II), усиливая этот процессс, тогда как в теломерах Taz1-зависимый мханизм уменьшается RNAi (механизм III). После метилирования H3K9 белки Clr4 и Swi6 связываются с хромосомой, поддерживая MeH3K9 эпигенетически (механизм IV).
Гены в гетерохроматине
 Гены в гетерохроматине L-плеча второй хромосомы дрозофилы
Гены в гетерохроматине L-плеча второй хромосомы дрозофилы
Сокращения.
H4K12 - так обозначается определенная аминокислота в гистоновых белках. В данном случае это лизин (K) в девятом положении гистона H4.
ORF (Open Reading Frames) - рамка считывания, участок ДНК с которого считывается РНК.
Sp (Schizosaccharomyces pombe) - вид дрожжей
Механизмы диминуции
Привет, Настя!
- Swaminathan J., Baxter E., Corces V. (2005) The role of histone H2Av variant replacement and histone H4 acetylation in the establishment of Drosophila heterochromatin. Genes & development 19:65-76.
- Verdel A, Jia S., Gerber S., Sugiyama T., Gygi S., Grewal S., Moazed D. (2004) RNAi-mediated targeting of heterochromatin by the RITS complex. Science, 30;303(5658):672-6.
- HornP. J., Peterson C.L. (2006) Heterochromatin assembly: A new twist on an old model. Chromosome Research 14:83Y94
- Fransz P. ,Hoopen R.,Tessadori F. (2006) Composition and formation of heterochromatin in Arabidopsis thaliana. Chromosome Research 14:71–82
Диминуция хроматина
Немного истории

В первые явление диминуции было открыто немецким цитологом Теодором Бовери (1862 - 1915) в 1887 году. Он обнаружил, что в раннем развитии у некоторых видов аскарид будущие тканевые (соматические) клетки теряют часть хромосомного материала — хроматина. Решающий вклад в открытие и детальное изучение диминуции хроматина у простейших внес Д.Прескотт. В начале 70-х годов прошлого века американский ученый выявил этот феномен у брюхоресничных инфузорий при созревании вегетативных (т.е. выполняющих соматические функции) ядер - макронуклеусов. В середине 60-х годов изучением диминуции хроматина у циклопов занималась С.Берман. Немецкая исследовательница обратила внимание на то, что число хромосом у тех трех видов циклопов, с которыми она работала, было одинаковым как до диминуции, так и после нее. Конечно, за счет этого события размеры хромосом уменьшались в зависимости от доли потерянной ДНК. Берман предложила молекулярную модель диминуции: избыточная ДНК выводится из хромосом подобно тому, как профаг исключается из хромосом лизогенных бактерий, т.е. путем выпетливания и внутрихроматидной рекомбинации с образованием колец из ДНК. Кольца Берман и обнаружила при электронно-микроскопическом исследовании разрушенных клеток циклопов в стадии диминуции. К сожалению, работы Берман прервались в 1984 г.
Парадокс генома высших эукариот
В середине XX века, так же как и во времена Ч. Дарвина во всех школьных учебниках по биологии схематически изображалось развитие жизни на Земле в виде эволюционного древа. В его основании находились простые и, как думали, самые древние организмы, а на вершине непременно располагался человек. Поэтому была вполне естественной точка зрения, согласно которой у Homo sapiens должно быть наибольшее число генов, т.е. и количество ДНК. Однако в 1952 году американские биохимик А.Мирский и цитолог Х.Рис доказали, что нет прямой зависимости между сложностью организации вида животных и количеством генетического материала, которым он обладает. В настоящее время расшифрованы полные геномы (т.е. нуклеотидные последовательности ядерной ДНК) нескольких организмов, в том числе, разумеется, и человека. Оказалось, что в сумме его гены вместе с регуляторными участками едва ли превышают 3-5% всего генома. О назначении остальной ДНК сегодня мы фактически ничего не знаем и не понимаем ни ее эволюционной роли, ни механизма происхождения.
Диминуция у инфузории
Taxonavigation Superregnum: Eukaryota Regnum: Protista Phylum: Ciliophora
 Инфузория Tetrahymena thermophila — модельный объект для изучения одноклеточных эукариот (фото с сайта mcdb.colorado.edu)
Инфузория Tetrahymena thermophila — модельный объект для изучения одноклеточных эукариот (фото с сайта mcdb.colorado.edu)При созревании Ма (макронуклеуса) происходит диминуция хроматина, об этом свидетельствует тот факт, что геном Ма брюхоресничных инфузорий гипотрихид родов Stylonychia, Euplotes и Oxytricha содержат лишь 2-4% нуклеотидных последовательностей генома Ми (микронуклеус) генеративного ядра, аналога зародышевой линии (germ line) многоклеточных. Следовательно 96-98% генома теряются при созревании Ма. Процесс диминуции характерен для всех представителей родов Tetrahymena, Paramecium (класс Oligohymenophorea), Stylonychia, Euplotes и Oxytricha (класс Spirotrichea). Из всех инфузорий наиболее кардинальный процесс реорганизации ядерного материала в онтогенезе можно наблюдать у гипотрихид. При созревании Ма диминуция происходит дважды. Первый раз удаляются целые хромосомы: через 10-15 часов после расхождения коньюгантов у Stylonychia lemnae примерно 140 хромосом становятся более компактными, перемещаются к внутренней мембране оболочки язра и затем дегенерируют. Оставшиеся 35-36 хромосом постепенно политенизируются, и еще через сутки начинается внутрихромосомная элиминация ДНК. Происходит она следующим образом: диски политенных хромосом поодиночке или небольшими группами окружаются мембраноподобным материалом, образуя пузырьки. Вся политенная хромосома распадается на множество независимых пузырьков, в которых лизируется удаляемая ДНК: элиминируется большая часть высокоповторенных последовательностей, спейсеры (межгенные промежутки), мобильные элементы генома, а так же внутренние элиминируемые последовательности (ВЭП). Все изученные до сих пор гены, а их более 20, содержат ВЭП. В целом их число в Ми составляет несколько десятков тысяч. ВЭП имеют на флангах короткие повторы (2-19 пн), при участии которых, возможно, и происходит сплайсинг кодирующих последовательностей ДНК Ма. Остаются только генетически значимые последовательности, к ним с обоих концов присоединяется теломерная ДНК, затем оболочки пузырьков распадаются и Ма превращается в "мешок с генами". В то же время происходит процессинг ДНК. В результате двух актов диминуции только 2 % последовательностей ДНК, имеющихся в Ми, остается в зрелом Ма.
Диминуция у аскарид
Наиболее подробно ДХ (диминуция хроматина) изучена у Parascaris univalens и Ascaris suum. ДХ у Parascaris univalens происходит последовательно в клетках соматической линии со второго по шестое деления дробления. Зигота содержит две хромосомы , в каждой из которых можно выделить тонкий прицентромерный и утолщенные концевые районы. В 1887 году Бовери обнаружил, что уже во время второго деления дробления в одной из клеток P. Univalens утолщенные концы хромосом отделяются от средней части и, не имея центромер, остаются в районе экватора, где дегенерируют. В результате утрачивается существенная часть хромосом. Клетка, прошедшая диминуцию, дает начало клону клеток, имеющих значительно укороченные хромосомы. Что касается второй дочерней клетки, в ней диминуция не происходит и она дает начало двум новым клеткам, одна из которых опять подвергнется диминуции, а другая нет. В результате получается эмбрион, состоящий из 32 клеток, в которых только две имеют полный набор последовательностей ДНК. Из них затем формируются клетки зародышевого пути, а из оставшихся 30 развиваются соматические клетки.
Показано, что экспозиция развивающихся эмбрионов Parascaris univalens в хлористом литии приводит к инициации диминуционных процессов во всех бластомерах у части зародышей, изменяя поведение бластомеров зародышевой линии и вызывая у них сходство с соматическими бластомерами в том, что касается схемы деления, ориентации митотического веретена деления и синхронизации клеточных делений. Высказано предположение, что экспозиция в хлористом литии зародышей P. univalens инактивирует цитоплазматические факторы, которые предотвращают ДХ в бластомерах, дающих в конечном итоге линию клеток зародышевого пути. Интересна также закономерность, которую наблюдали эти же авторы: хлористый литий индуцировал ДХ в клетках зародышевой линии с 1-го по 4-е деления дробления, но не после 4-го деления. Эта особенность поведения клеток зародышевой линии после 4-го деления дробления строго детерминирована и показывает, что развитие клеток зародышевого пути, начиная с этого этапа, не может быть изменено на направление, сходное с развитием соматических бластомеров. Аналогичным действием на зародыши P. univalens обладает цитохалазин-В. Эмбрионы, обработанные цитохалазином-В, осуществляют только симметричные деления, похожие на деления соматических клеток, и все бластомеры дробящегося яйца подвергаются ДХ. Вероятно, данные по влиянию цитохалазина-В на эмбриогенез P. univalens указывают, что распределение цитоплазматических факторов, определяющих ход ДХ, зависит от целостности микрофиламентов.
Исследование не обработанных какими-либо агентами, эмбрионов P. univalens, при использовании антитела anti-myosin II, обнаружило различное распределение миозина между пресоматическими бластомерами и бластомерами-родоначальниками зародышевого пути. Учитывая тот факт, что актин и миозин участвуют в переносе некоторого количества РНК, а также данные, согласно которым белки цитоскелета, особенно актин, отвечают за закрепление локализованной мРНК, была высказана гипотеза, из которой следует, что микрофиламенты, связанные с мРНК, транспортируют и/или закрепляют определенные цитоплазматические факторы, вызывающие ДХ в течение раннего развития эмбрионов Parascaris.
Противоположное действие по отношению к хлористому литию и цитохалазину-В оказывает NaSCN. У эмбрионов, выдержанных в растворе этой соли со стадии зиготы до 4–клеточной стадии, появляются многоядерные эмбрионы, в которых не проходят диминуционные деления, а анализ веретена деления обнаруживает множественные полюса и очевидный недостаток микротрубочек. Высказывается предположение, что действие NaSCN состоит в процессе денатурации фибриллярных белков, но не в специфическом влиянии на ДХ.
Диминуция у циклопов
Кроме аскарид ДХ происходить и у некоторых видов циклопов. Она происходит во время 4-7 деления дробления (у разных видов). Хроматин элиминируется из различных участков хромосом: терминальных гетеропикнотических фрагментов у Сyclops Divulus, C.furcifer, или из интеркалярных - у C.strenuus. Элиминируемый хроматин остается в виде крупных блоков или гранул в экваториальной части веретен деления.
В работах А.П. Акифьева и А.К. Гришанина наиболее полно описан процесс ДХ у C.kolensis. Диминуция у этого вида происходит во время 4-го деления дробления в 6 клетках зародыша из 8 и характеризуется тем, что в конце значительно удлененной интерфазы в ядрах этих шести клеток поялвяются мелкие фельгенположительные гранулы или капли (около 600 в каждой клетке). Гранулы имеют диаметр порядка 0,5-3,5 мкм. По мере наступления профазы и следующих стадий диминуционного деления хроматиновые гранулы сливаются, вокруг них формируется плотная однослойная, лишенная пор мембрана толщиной около 50 нм. Лизис элиминируемой ДНК (эДНК) происходит, вероятно, внутри этих гранул. эДНК представляет собой циклические структуры, поэтому если бы мембрана имела поры, то внутрь гранул с началом телофазы мог бы свободно поступать фактор(ы) декомпактизации. В таком случае гранулы с эДНК превратились бы в обычные микроядра, которые в сумме содержали бы большую часть генетического материала клетки. Уникальная мембрана гранул обеспечивает надежную изоляцию материала, подлежащего лизису, и таким образом предотвращает возникновение хаоса в постдиминуционных клетках.
Продолжительность интерфазы перед диминуцией значительно увеличивается, после вновь укорачивается. у C.kolensis удаляется до 94% генома зародышевых клеток. В ходе диминуции число хромосом остается неизменным, однако их размеры резко уменьшаются (у C.kolensis c 11-20 до 2,6 мкм, а диаметр - с 1 до 0,5 мкм).
В заключении
К сожалению, диминуция хроматина пока слабо изучена методами молекулярной биологии. Вот почему полное описание всех ее этапов затруднено. Тем не менее с достаточной уверенностью можно говорить о следующих событиях,
1. «Принятие» клеткой программы диминуции хроматина. Отнюдь не случайно у циклопов промежутки до и после диминуционного деления в восемь-девять раз короче, чем предшествующий период.
2. Маркировка последовательностей ДНК, которые должны быть элиминированы, с одной стороны, и которые подлежат сохранению — с другой. Сотни и даже тысячи участков, в которых происходит диминуция хроматина в хромосомах, должны быть приведены в состояние готовности к диминуции одновременно.
3. Разрезание ДНК в маркированных участках.
4. Сшивание неэлиминируемой ДНК в «мини-хромосомы».
5. Образование уникальной по своей структуре мембраны, формирующей гранулу, в которую, как в консервную банку, заключена элиминируемая ДНК (впервые процесс описан А. К. Гришаниным).
6. Деградация ДНК внутри этих гранул.
- И. Ф. Жимулев "Общая и молекулярная генетика"
- А. К. Гришанин, А. П. Акифьев, А. К. Шеховцов, И. Ф. Жимулев, Т. В. Бойкова "Проблема диминуции хроматина на рубеже ХХ и ХХI веков"
- А. П. Акифьев "Острова в океане, или парадоксы эволюции генома"
- А. П. Акифьев "Избыточная ДНК - генетическая квадратура круга?"
- Т. В. Бойкова "Структура ДНК, элиминируемой в ходе диминуции хроматина у Cyclops Kolensis (Crustacea: Copepoda)"
- http://www.wikipedia.org
Теломеры
Теломеры - концевые участки хромосом.
Теломерные последовательности у разных организмов
TTAGGG - Human, mouse, Xenopus, Neurospora crassa, Physarum, Didymium, Trypanosoma, Crithidia, Aloe, Asparagus
AG(1-8) - Dictyostelium
TTGGGG - Tetrahymena, Glaucoma
TTGGG(T/G) - Paramecium
TTTTGGGG - Oxytricha, Stylonychia, Euplotes
TTAGGG(T/C)- Plasmodium
TTTAGGG - Arabidopsis thaliana
TTTTAGGG - Chlamydomonas
TTAGG - Bombyx mori
TTAGGC - Ascaris lumbricoides
TTAC(A)(C)G(1-8) - Schizosaccharomyces pombe
TG(2-3)TG(1-6) - Sc
TTAGGC - Caenorhabditis elegans
Теломеры человека
Повторы TTAGGG соединяется с белками: TRF1, TRF2, TIN2, Rap1, TPP1, POT1, называемые шелтеринами.
TRF1, TRF2 и POT1 напрямую узнают TTAGGG повторы. Эти белки сцепляются с тремя другими белками - TIN2, Rap1 и TPP1 формируя комплекс, отличающий теломеры от сайтов повреждения ДНК. TRF1 и TRF2 формируют гомодимеры, POT1 связывает одноцепочечный сайт 5'-(T)TAGGGTTAG-3' (рис.1)
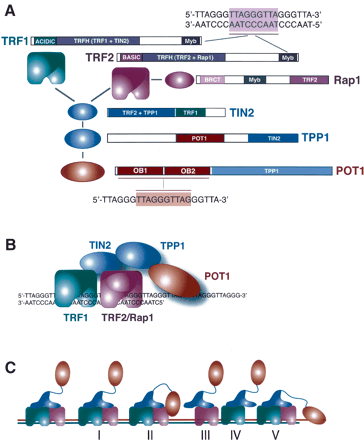 рис.1 Белки шелтерины. (A) Домены белков и их взаимодействие с другими белками и ДНК. (B) Сборка комплекса на теломере. (С) Различные субкомплексы и возможные их взаимодействия с теломерной ДНК.
рис.1 Белки шелтерины. (A) Домены белков и их взаимодействие с другими белками и ДНК. (B) Сборка комплекса на теломере. (С) Различные субкомплексы и возможные их взаимодействия с теломерной ДНК.
Шелтерины формируют защитный комплекс на конце теломеры, участвуют в образовании Т-петли и контролируют синтез теломерной ДНК при участии теломеразы (рис.2).
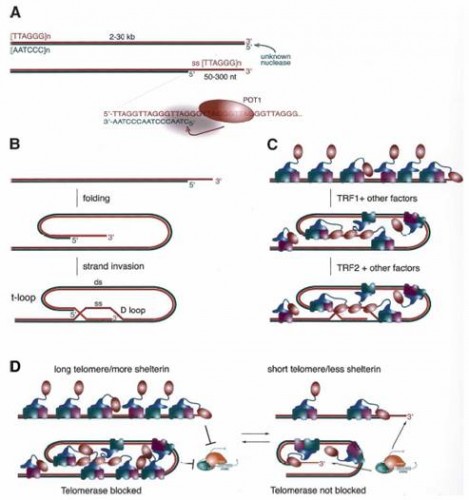 рис.2 (А) Образование конца теломеры. (В) Образование Т-петли. (С) Предполагаемое участие шелтеринов в формировании Т-петли. (D) Модель удлинения теломеры.
рис.2 (А) Образование конца теломеры. (В) Образование Т-петли. (С) Предполагаемое участие шелтеринов в формировании Т-петли. (D) Модель удлинения теломеры.
Теломеры дрожжей
У дрожжей, как и у большинства эукариот теломеры состоят из G-богатых повторов. 3'-конец теломеры выступает в виде одноцепочечного фрагмента.
Silent information regulator (Sir) - белок предотвращающий молчание генов вблизи теломер
Sir2 - гистон деацетилаза, связывается с ацетилированными N-концами гистонов. В отличие от большинства деацетилаз Sir2 использует NAD+ как кофактор
Теломеры дрозофилы
Дрозофила лишена типичных для большинства организмов теломер, не смотря на то, что они были открыты именно на плодовой мушке. У дрозофилы отсутствует теломераза и удлинение теломер происходит путем перемещения транспозонов.
Теломеры состояти из субтеломерных сателлитных повторов ДНК TAS и концевого набора, состоящего из трех ретротранспозонов без LTR: HeT-А, TAHRE и TART.
TAS (Telomere-associated satellite) - сателлиты длинной 400 пн - 1,8 тпн, занимают несколько килобаз ДНК.
TART имеет две рамки считывания ORF1 и ORF2 называемые gag и pol за свое сходство с белками ретровирусов (см. обзор Вирусы). ORF2 TART кодирует протеазу и RT - обратную транскриптазу. у HeT-A отсутствует ORF2 и RT кодируется в каком-то другом месте. HeT-A и TART имеют длинные 3'-UTR, причем у HeT-A состоящий из несовершенных повторов. Для транскрипции HeT-A необходим промотор располагающийся в 3' UTR предыдущего элемента. HeT-A транскрибируется в нормальном 5'-->3' направлении, а TART в смысловом и антисмысловом. Функция антисмыслового транскрипта не известна. HeT-A в несколько раз больше, чем TART. Они случайно перемешаны и располагаются друг за другом. Фрагменты этих повторов встречаются в прицентромерном гетерохроматине и никогда не встречаются в эухроматине.
Особенностью HeT-A и TART является их высокая изменчивость у разных видов дрозофил. HeT-A D.yakuba имеет только 55% гомологии с D.melanogaster.
Теломера теряет ~75 пн за один раунд репликации и восстанавливается за счет перемещения транспозонов TART, TAHRE и HeT-A.
Концы политенных хромосом морфологически различаются у разных линий дрозофил. Обнаружено, что удлинение хромосом связано с накоплением TART и HeT-A. Мутации генов E(tc) и HP1 связаны с изменением длины теломер.
Белки участвующие в образовании теломер и белки регуляторы: HOAP, HP1, Rad50, Mre11, UbcD1 (гомолог E2), Ku70/80 (гетеродимер). Концевой кепирующий комплекс дрозофилы образуется вне зависимости от состава ДНК. HP1 связывается с одноцепочечной ДНК, к нему присоединяется HOAP.
Сокращения.
LTR (Long Terminal Repeat) - длиный концевой повтор.
UTR (Untranslated Region) - нетранслируемая область.
E(tc) - Enchaser of terminal-gene conversion.
Упаковка ДНК
В этом разделе рассматриваются различные уровни упаковки хроматина, наблюдаемые в оптический и электронный микроскопы
 30 нм фибрилла
30 нм фибрилла
Гистоны
ГИСТОНЫ
Гистоны - белки образующие комплекс связывающийся с ДНК и участвующий в сворачивании ДНК - фолдинге и регуляции экспрессии.
Характеристика гистонов
| гистон | аминокислот | N-плечо | C-плечо |
| H3 | 135 | 41 | 25 |
| H4 | 102 | 32 | - |
| H2A | 129 | 24 | 16 |
| H2B | 125 | 30 | 23 |
| H1 |
Выделяют 5 фракций гистонов
| Фракция | Лизин | Аргинин | лиз./арг | осн.АК/кис.АК | Мол. вес (Да) |
| Н1 (очень богатая лизином) | 29% | 1% | >20 | 5.4 | 23000 |
| Н2В (умеренно богатая лиз) | 16% | 6% | ~2.5 | 1.7 | 13774 |
| Н2А (умеренно богатая лиз и арг) | 11% | 9% | ~1 | 1.4 | 13960 |
| Н4 (богатая арг и гли) | 11% | 14% | ~0.8 | 2.5 | 11282 |
| Н3 (очень богатая арг); есть цис, а в других – нет | 10% | 13% | ~0.7 | 1.8 | 15348 |
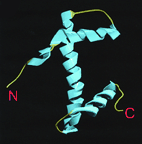
рис.1 Общая структура для гистонов H2A, H2B, H3, H4. Три центральные а-спирали образующие фолд домен и свободные концевые участки подвергаемые различным модификациям (см. обзор Модификации гистонов)
Гистоновые гены (Сингер Гены и геномы)
| вид | группа гистоновых генов | кластер, тпн | число копий |
| Дрожжи Sc | ←H2A→H2B ←H3→H4 |
6 и 13 | 2 2 |
| Dm | ←H3→H4←H2A→H2B←H1 | 5 | 100 |
| Морской еж S.purpuratus | →H1→H4→H2B→H3→H2A рассеянные, нек образ пары | 6-7 | 500 ранние 10 поздние |
| Тритон N.viridescens | ←H4←H2A→H2B←H3←H1 | 9 | 700 |
| Xenopus | H3-H4-H2A-H2B-H1B-H3-H4 →H3→H4←H2A→H2B |
16 6 |
25 |
| Курица | ←H3→H2A←H4-H1←H2A→H2B H2A-H4-H2A-H2B H3-H4 H5 (вместо Н1 в эритроцитах) |
14 >10 >10 |
10 1 |
| Человек | H3-H4-H4-H3-H2A-H2B H4-H3-H1-H2B-H2A →H2A→H2B←H4 |
20 15 6 |
10-20 5 неизвестно |
Большинство гистоновых генов (гг) синтезируется в S-фазе клеточного цикла. Гг объединены в кластеры но транскрибируются отдельно. У птиц и млекопит рассеяны по геному. Большинство реплицирующихся гг лишены интронов, у мРНК нет 3'-poly(A)-конца.
Морской еж: на ранних стадиях развития функционируют специфические гг, ответственные за быстрый синтез гистонов. После образования бластулы начинается синтез других гг.
Dm: гг находятся во второй х-ме. В эмбриогенезе, возможно, гистоны образуются с альтернативных гг.
Гистон H1
Гистон H1 соединяется с нуклеосомой ДНК и участвует в образовании 30 нм фибриллы. Присутствует у животных, растений и грибов. У некоторых архебактерий имеются схожие аналоги.
Гистон H2A
Гистон H2B
Гистон H3
Гистон H4
Аналоги гистонов
| гистон | Hs, Mm | Dm | Sc |
| H2A | H2AX H2A1 H2A.Z H2ABbd macroH2A |
H2Av
H2Av |
Htz1 |
| H2B | - | - | - |
| H3 | H3.3 Cid |
||
| H4 | - | - | - |
| H1 | H1.1 H1.2 H1.3 H1.4 H1.5 H10 H1t H1oo |
Hho1p |
аналоги H2A
H2AX - играет роль в репарации ДНК, SQEY мотиф Р в сайтах где ДНК повреждена и собирает репарирующие белки.
H2A.X фосфорилируется во время апоптоза, что приводит к разрушению ДНК, участвует по крайней мере в одном пути репарации у мышей (см. обзор Репарация ДНК). (Smith et al., 2002)
H2A1 - инактивация Х-х-мы и дозовая компенсация у млекопит.
H2A.Z (Htz1 у дрожжей) существенный белок дрозофилы, мышей и Sc. вовлеченный в активацию и подавление транскрипции. (Swaminathan 2005)
H2Av Dm пресутствует в хромоцентре гетерохроматина и связан с транскрибируемыми и нетранскрибируемыми генами в дисках и междисков политенной хромосомы. His2Av схож генетически с PcG генами и мутации в His2Av подавляют PEV, предполагает что выриант гистона необходим для эухроматинового сайленсинга и образования гетерохроматина. His2Av мутанты обнаруживают уменьшение ацетилирования гистона H4 лизина Lys 12, увеличивается метилирование гистона H3 Lys 9, и уменьшается соединение HP1 с прецентромерными регионами. H2Av накопление или ацетилирование H4K12 не затрагивается мутациями в Su(var)3-9 или Su(var)2-5. В каскаде ведущему к установлению гетерохроматина и присоединению варианта H2Av обеспечивается H4K12 ацетилированием, являющемся необходимым шагом для метилирования H3K9 и просоединения HP1. (Swaminathan 2005)
H2ABbd (Barr body deficient) вариантгистона с 48% идентичностью к гистону H2A обнаружен в 2001 г. H2ABbd короче чем обычный H2A, и содержит последовательнотсь из шести аргининов на конце и имеет нестандартный для всех H2A С-конец. Аминокислотная последоватльность фолд домена гистона H2ABbd существенно отличается от H2A
macroH2A инактивация Х-хромосомы у млекопитающих. MacroH2A участвует в присоединении транскрипционного фактора и SWI/SNF нуклеосомном ремоделингею. (Gautier, 2004)
аналоги Н2В не обнаружены
аналоги Н3
(Dm) H3.3 - в активном хроматине, Cid - компонент прицентромерного гетерохроматина. Перемещение H3 только при репликации, H3.3, Cid во всем кл цикле | перемещение H3.3 не согласуется с репликацией | H3 отличается от H3.3 на 4 аминокислоты.
зависимости м-у увеличением уровня ацетилирования гистонов и повышения уровня экспрессии (Smith, 2002)
Гистон H3.3 вовлечен в репликацию ДНК и может лужить маркером роматиновых регионов высокой транскрипционной активности.(Smith, 2002)
Гены гистонов имеют 3’ нетранскрибируемый район вместо poly(A)-конца. Dm: один ген кодирует Сid и два Н3.3 вне S фазы
Н3.3 и Н3 встраиваются во время репликации, Н3.3 и Cid могут встраиваться не зависимо от репликации. Н3-подобный центромерный гистон СеnН3 наблюдается у разных животных, грибов и растений. Н3.3-подобный гистон в активном макронуклеусе Ciliate. Варианты Н3 занимают малую часть хроматина и их свойства обычно не наблюдаются.(Ahmad, 2002)
Сначало собирается (H3-H4)2 – тетрамер и затем добавляются два H2A-H2B димера. Новые гистоны собираются, добавляется H1 и модифицируются гистоновые плечи. (Ahmad, 2002)
PCNA – proliferating cell nuclear antigene
аналоги Н4
аналоги Н1
H1.1-H1.5,H10,H1t - субтипы у млекопит. Гистон H5 в придшеств эритроцитов курицы
H1oo был обнаружен в ооцитах мыши. H5 встречается только у амфибий и рептилий, где он обнаружен в изобилии в транскрипционно неактивных ядрах эритроцитов. Ядро зрелых эритроцитов почти полностью гетерохроматиновое, что позволяет поддерживать малый объем хроматина. Экспрессия гистона H5 коррелирует с прекращением работы RNA-полимеразы II. Предполагается, что гистон H5 участвует в инактивации генома и является частью программы конечной дифференциации эритроцитов. Гистон H1.0 гомолог млекопитающих близок по структуре к H5 чем к H1. Исследования показали что его колличество увеличивается в клетках закончивших дифференцировку. Оверэкспрессия гистона H1.0 способна замедлить прохождение клеточного цикла и подавить экспрессию. H1.0 может конкурировать с одинаковыми последовательностями хроматина с RNA-полимеразой II. H1 состоит из центрального глобулярного домена фланкированного по краям хвостовыми доменами. Наибольшее различие между вариантами заключается в различии их хвостовых доменов. N-конец не требуется для индукции высокоорганизованных структур. С-конец необходим для сворачивания хроматина, но не существеннен в защите от нуклеаз связанного с присоединением гистона H1. Точечная мутация и делеционные эксперименты с участием гистона H1.1 показали что одиночное фосфорилирование cdk в пределах С-концевого домена может отвечать за сборку всей гистоновой молекулыe. (Th’ng 2005)
Экспрессия гистоновых генов и сборка нуклеосом
Во время репликации материнские гистоны случайно распределяются по обеим цепям ДНК. Вновь синтезированные гистоны дополняют нуклеосомы. Разделение нуклеосом и добавление новых гистонов, степень репликации и синтез гистонов четко координируется.
Во время S-фазы происходит синтез ДНК, синтез гистонов и образование нуклеосом. Эти три события начинаются одновременно в начале S-фазы. Если подавлять синтез ДНК ингибиторами, то подавляется и синтез гистонов. Механизм точного контроля не известен.
При ингибировании синтеза гистонов или сборки хроматина также происходит ингибирование синтеза ДНК
Человеческий белок HIRA (histone regulator A) ответственен за контроль синтеза гистонов. Hir1p, Hir2p -репрессоры транскрипции гистонов Sc.В фибробластах Hs HIRA колокализуется с HDAC4. HIRA - субстрат циклинаА или E/cdk2 в S-фазе. Фосфорилирование HIRA циклином/cdk2 регулирует экспрессию гистонов во время клеточного цикла. SLBP - белок стабилизирующий гистоновую мРНК.
CAF1 (Chromatin Assembly Factor) - белковый комплекс из 3 субъед: 150, 60, 50 кДа связывает вновь образ гистоны Н3 и Н4 с ДНК с образованием тетрамера, содержит p150, p60 и p48. Активность CAF1 зависит от связи p150CAF1 с p60CAF1 и с вспомогательными факторами репликации, PCNA (Adams, 2001 scientific report) Вновь синтезируемые H3 и H4 связываются первыми двумя субъединицами (150, 60), из которых пид 150 кДа обладает заряженным доменом, а др содержит в своем составе WD-повтор(TrpAsn). Затем к нуклеосоме добавляются H2A и H2B так же при участии шаперонов с образованием октамера. Шапероны способны запасать гистоны, перемещать к ядру, обменивать гистоны на ДНК, укладывать гистоны в нуклеосому.
Транскрипция ДНК в нуклеосоме подавляется Swi-Snf комплексом.
Гистоны прокариот
Нуклеоид прокариот представляет ~100 петель. Эти петли конденсированы основными протеинами и другими плохо изученными факторами. HU белки (Hu-1 и Hu2) ~18кДа существуют как гетеродимеры. H-NS белок 16,5 кДа формирует димер связывающий ДНК. Имеется ~20000 H-NS молекул, что составляет один димер на ~400пн ДНК.
У аналогов коровых гистонов архебактерий отсутствуют 'хвосты'.
- Drlica K, Rouviere-Yaniv J. (1087) Histonelike proteins of bacteria. Microbiol Rev. 51(3):301-19. Adams, 2001
- Downs, 2003
- H. KASINSKY, J. LEWIS, J. DACKS, J. AUSIO (2001) Origin of H1 linker histones. The FASEB Journal;15:34-42
- C. M. Smith et al., (2002). Proc Natl Acad Sci U S A Ahmad, 2002
- Th'ng JP, Sung R, Ye M, Hendzel MJ. (2005) H1 family histones in the nucleus. Control of binding and localization by the C-terminal domain.
- J Biol Chem. Jul 29;280(30):27809-14. Epub 2005 May 23
- Gautier Histone variant H2ABbd confers lower stability to the nucleosome, 2004
- Chadwick & Willard, 2001
- Swaminathan J, Baxter EM, Corces VG. (2005) The role of histone H2Av variant replacement and histone H4 acetylation in the establishment of Drosophila heterochromatin. Genes Dev. Jan 1;19(1):65-76.
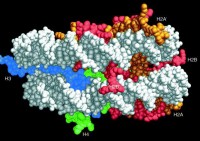
Нуклеосомы
Нуклеосома - белковый комплекс, состоящий из гистонов состава [2H2A, 2H2B, 2H3, 2H4].
Характеристика нуклеосомы
| нуклеосома 5,5x11нм | 146пн |
| нуклеосома+H1 | 166пн |
| нуклеосома+H1+линкер (участок м-у н.) | 200пн |
ДНК в B-форме перекручена на 0,25-0,35 пн на виток спирали, при этом шаг спирали 10,2 пн/виток (у В-формы в растворе - 10,5 пн/виток). Такая ДНК делает 1,75 левых оборота вокруг нуклеосомы. Комплекс не разрушается при разрушении плеч гистонов. N-концевые домены Н3 контактируют с ДНК на входе в коровую частицу и выходе из нее, Н4 связывается с внутренней частью ДНК нуклеосомы
H1 - линкерный гистон и выполняет функцию связывания нуклеосом между собой, однако у дрожжей H1 не обнаружен, а его аналог Hho1p не выполняет видимой роли в сворачивании ДНК и взаимодействии нуклеосом между собой.
Sc
Hho1p has sequence homology to other known linker histones and interacts with nucleosomes in vitro. Strains with a disruption mutation in HHO1 have no detectable defects in chromatin structure, transcriptional silencing at telomeres or mating type loci, or growth rates relative to wild-type strains. Analysis of transcription in hho1 mutant yeast demonstrated that expression of only 27 of 6216 genes was affected. This lack of marked phenotypic changes in the absence of Hho1p has made it difficult to determine the in vivo function the protein. Similarly, the function of linker histones in higher eukaryotes remains elusive. While a vast array of biochemical data support the model that linker histones facilitate chromatin condensation, the functional consequence of this activity in the cell is not entirely clear. H1 has been proposed to act as a general repressor of transcription. However, it appears that H1 specifically regulates individual genes in both positive and negative manners. Hho1p is inhibitory to DNA DNA double-strand breaks repair by homologous recombination.
(Downs 2003)
Наднуклеосомная укладка хроматина.
Структура 30 нм хроматиновой фибриллы.
 Упаковка ДНК в нуклеосомах в кристаллах. Каждое кольцо представляет собой отдельную нуклеосому (белковая часть нуклеосомы не показана). (А) X.laevis. (B) S.cerevisiae. Реальная упаковка нуклеосом возможно не соответствуют упаковке в кристаллах. Гистоны H2A, H2B, Н3 и H4 имеют соответственно 72, 67, 84 и 92% гомологии у хенопуса и дрожжей. [White, 2001]
Упаковка ДНК в нуклеосомах в кристаллах. Каждое кольцо представляет собой отдельную нуклеосому (белковая часть нуклеосомы не показана). (А) X.laevis. (B) S.cerevisiae. Реальная упаковка нуклеосом возможно не соответствуют упаковке в кристаллах. Гистоны H2A, H2B, Н3 и H4 имеют соответственно 72, 67, 84 и 92% гомологии у хенопуса и дрожжей. [White, 2001]
- Cindy L. White, Robert K. Suto and Karolin Luger Structure of the yeast nucleosome core particle reveals fundamental changes in internucleosome interactions The EMBO Journal (2001) 20, 5207–5218
Хромосомные перестройки
Этот раздел посвящен хромосомным перестройкам, явлениям рекомбинации хромосомных последовательностей в результате определённых воздействий
Делеции
Делеция (от лат. deletio — уничтожение) - потеря участка хромосомы. Делецией называют потерю одной или более нуклеотидных позиций в последовательности.
 Делеции подразделяются на интерстициальные (потеря внутреннего участка) и терминальные (потеря концевого участка).
Делеции подразделяются на интерстициальные (потеря внутреннего участка) и терминальные (потеря концевого участка).
Причины возникновения делеций:
1. Делеция может быть следствием разрыва хромосомы.
2. В результате неравного кроссинговера в мейозе.
3. В результате проскальзывания при репликации. Оно происходит если в последовательности содержится много коротких повторов.
4. Проскальзывание при участии коротких повторов может происходить и в нормальной не реплицирующейся хромосоме. Тогда образуются петли и ферменты репарации удаляют обе или одну из них. Это также приводит к разнообразным мутационным событиям.
 Вид делеции на цитологическом препарате политенных хромосомах дрозофилы. Гетерозиготные делеции цитологически выявляются из-за наличия петли в нормальном гомологе.
Вид делеции на цитологическом препарате политенных хромосомах дрозофилы. Гетерозиготные делеции цитологически выявляются из-за наличия петли в нормальном гомологе.
Делеции обозначаются как Df(1)E-F, где (1) - номер хромосомы, а E-F - удаленный сегмент хромосомы.
Картирование с помощью делеций.
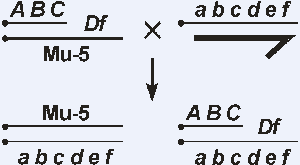 Пример картирования генов расположенных в Х-хромосоме дрозофилы. Самок гетерозиготных по делеции Df и по балансерной хромосоме Mu-5 скрещивают с самцами, несущими хромосому с рецессивными аллелями (а-f) картируемых генов.
Пример картирования генов расположенных в Х-хромосоме дрозофилы. Самок гетерозиготных по делеции Df и по балансерной хромосоме Mu-5 скрещивают с самцами, несущими хромосому с рецессивными аллелями (а-f) картируемых генов.
Дупликации
Дупликация (от лат. duplicatio - удвоение) - тип хромосомной перестройки ( мутации ), заключающийся в удвоении какого-либо участка хромосомы .
Дупликации также могут возникать в результате рекомбинации между короткими хромосомы E.coli использует 12-н.п. повторы Систематическое изучение формирования дупликаций в плазмиде F' E.coli подтвердило это. Lac -ревертанты нити, несущей беспромоторный ген lacZ,произошли от сплавки lacZ с близлежащим промотором . Большинство из этих ревертантов были нестабильны в отсутствие Lac селекции и несли дупликации 5-20 kb, которые произошли в результате сплавки lac генов с промоторами. Более 90% независимых дупликаций (28 из 30) использовали 3-8 н.п. прямые повторы, смежные с дополнительными районами гомологии. Несколько повторов было использовано рекуррентно, чаще всего (12 из 30 случаев) совпадающие в 14 из 18 н.п. . В другой работе спонтанные дупликации в плазмидах Streptomyces lavendulae также использовали короткие гомологии (5 н.п.) .
Инверсии
Инверсия (от лат. inversio - перестановка) - изменение структуры хромосомы, вызванное поворотом на 180° одного из внутренних её участков.
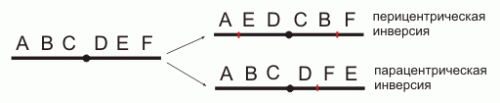
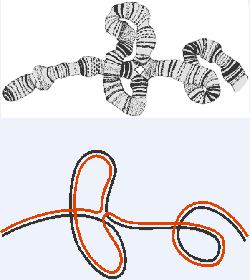 Инверсия хромосомы на цитологическом препарате политенной хромосомы дрозофилы.
Инверсия хромосомы на цитологическом препарате политенной хромосомы дрозофилы.
Запирание кроссинговера при инверсиях.
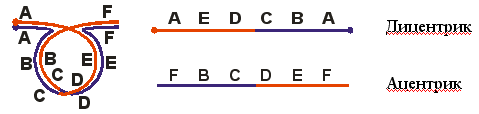
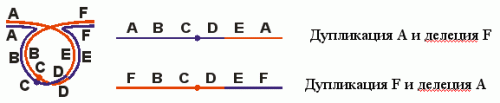
Транслокации
К сожалению, список литературы отсутствует.
Хромосомы типа ламповых щеток
К сожалению, список литературы отсутствует.
Центромеры
Центромеры - это хромосомные структуры ответственные за направление движения хромосом во время митоза. К функциям центромер относятся адгезия сестринских хроматид, образование кинетохора, спаривание гомологичных хромосом и вовлечение в контроль генетической экспрессии. У большинства эукариот центромеры не содержат определенной последовательности ДНК. Обычно они содержат повторы (например, сателлитной ДНК), схожие, но не идентичные. У нематоды Caenorhabditis elegans и некоторых растений хромосомы голоцентрические, т.е. образование кинетохора не локализовано определенным участком, а происходит диффузно по всей длине хромосомы.
Центромеры дрожжей
Центромера Sp длинной 35-110 тпн (чем хромосома длиннее, тем центромера меньше) и состоит из двух доменов - центральной коровой области и внешней области повторов (otr), предстравленной гетерохроматином (рис1). Центральная коровая область состоит из области неповторяющейся ДНК (cnt) и области инвертированных
повторов (imt) по краям cnt. В центральной коровой области нормальный гистон H3 заменен своим аналогом (CENP-A у Sc) и в этом месте собирается кинетохор. Маркерные гены встраеваемые в центромерную последовательность становятся транскрипционно неактивными. Их замолкание зависит от положения, например, на внешних повторах оно сильнее, а в центральной области менее выражено. Белки Mis6, Mis12, Mal2 и Sim4 связываются с центральным районом центромеры. Центральный район частично переваривается микрококковой нуклеазой, что указывает на особую организацию хроматина, причем эта организация не зависит от ДНК (ДНК перенесенная в Sp или в другие участки хромосомы не сохраняет такую организацию). Внешние повторы упакованы в нуклеосомы, с деацетилированными гистонами (при помощи деацетилаз Clr3, Clr6 и Sir2). Метилтрансфераза Clr4 диметилирует H3K9, на который садится Swi6 (аналог HP1) и Chp1. Таким образом, на центромере формируется гетерохроматин
(см. обзор Гетерохроматин). Swi6 отвечает за присоединение когезинов к области внешних повторов. otr состоят из dg и dh повторов, разделенные другими повторами. Внутренние и внешние повторы содержат кластеры генов тРНК. Установлено, что dg повторы имеют первостепенную роль в установлении центромерной активности.
ДНК центральной коровой области АТ-богатая и состоит из трех участков cnt1, cnt3 - гомологичны на 99%, расположены по кроям от сnt2 гомологичного с ними на 48%. Левый и правый imr инвертированы и уникальны для каждой центромеры.
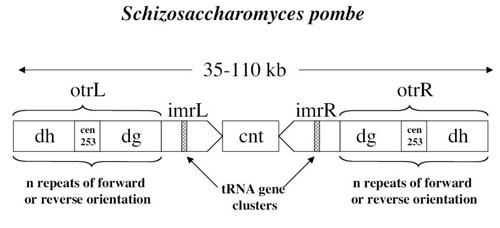 Рис. 1
Рис. 1Все 16 центромер Sc имеют длину 90 пн и содержат три элемента: CDEI, CDEII и CDEIII (рис.2). CDEII - это АТ-богатый неконсервативный спейсер длинной 78-90 пн, разделяющий CDEI и CDEIII. CDEI имеет длину 8 пн. Этот участок не существеннен для центромерной активности, но его делеция повышает вероятность неправильного расхождения хромосом во время митоза. СDEII - 78-90 пн, содержит ~90% АТ-пар. Делеции в этом участке прерывают образование центромеры, не нарушая расхождение хромомсом. СDEIII - 26 пн содержит несовершенные палиндромы. Одиночная нуклеотидная замена в этом участке полностью прерывает центромерную активность.
 Рис. 2
Рис. 2 Рис. 3 Последовательности центромерной ДНК хромосом Sc
Рис. 3 Последовательности центромерной ДНК хромосом Sc
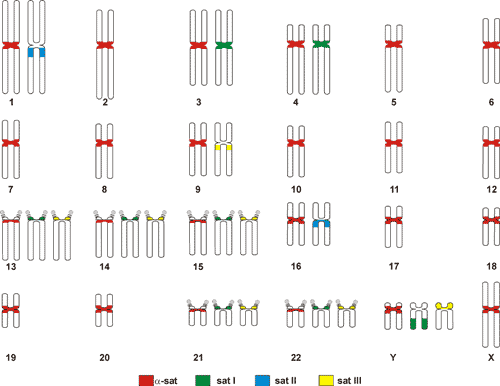
Центромеры человека
Центромера человека представляет участок 1-4 Мпн AT-богатого а-сателлита длинной ~171 пн (альфоид). Другие сателлиты также присутствуют. В пределах повторов устанавливается место образования центромеры называемое неоцентромера. Первичная последовательность ДНК в установившейся неоцентромере не имеет значения. Не все а-сателлиты становятся центромерой, не смотря на присутствие двух локусов богатых а-сателлитом, активной центромерой становится только один из них. Интактная ДНК, содержащая альфоид и помещенная в ядро, не образует активной центромеры, поэтому первичный механизм образования активной центромеры остается неясным.
Центромеры дрозофилы
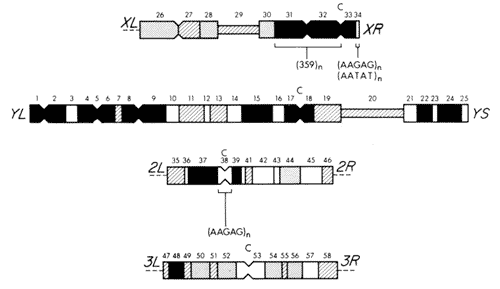 Рис. 4 Участки прицентромерного гетерохроматина у Drosophila melanogaster. Центромера указана буквой С
Рис. 4 Участки прицентромерного гетерохроматина у Drosophila melanogaster. Центромера указана буквой С
Центромеры арабидопсиса
 Рис. 5 Холоцентрические центромеры арабидопсиса
Рис. 5 Холоцентрические центромеры арабидопсиса
Читайте дополнительно:
Гетерохроматин
Кинетохор
Сокращения:
Sp (Schizosaccharomyces pombe ) - делящиеся дрожжи
Sc (Saccharomyces cerevisiae ) - почкующиеся дрожжи
cnt (central core region) - центральная коровая область
imr (innermost repeat) - внутренние повторы
otr (outer repeats) - внешние повторы
- Kniola B, O’Toole E, McIntosh JR et al. (2001) The domain structure of centromeres is conserved from fission yeast to humans. Mol Biol Cell 12: 2767Y2775.
- Pidoux A.L., Allshire R.C. (2005) The role of heterochromatin in centromere function. Philos Trans R Soc Lond B Biol Sci. 360(1455):569-79.
- Sharp J.A., Kaufman P.D. (2003) Chromatin proteins are determinants of centromere function Curr Top Microbiol Immunol, 274: 23–52.
Число хромосом у разных видов
| Вид | 2n |
| Человек (Homo sapiens) | 46 |
| Горилла | 48 |
| Макака (Macaca mulatta) | 42 |
| домашние животные | |
| Кошка (Felis domesticus) | 38 |
| Собака (Canis familiaris) | 78 |
| Кролик | 44 |
| Лошадь | 64 |
| Корова (Bovis domesticus) | 120 |
| Курица (Gallus domesticus) | 78 |
| Утка | 80 |
| Свинья | 40 |
| Овца | 54 |
| лабораторные животные | |
| Плодовая мушка (D.melanogaster) | 8 |
| Морской еж (Strongylocentrotus purpuratus) | 42 |
| Шпорцевая лягушка (Xenopus laevis) | 36 |
| Мышь (Mus musculus) | 40 |
| Дрожжи (S.cerevisiae) | 32 |
| Нематода | 22/24 |
| Крыса | 42 |
| Морская свинка | 16 |
| позвоночные | |
| Еж | 96 |
| Лиса | 34 |
| Голубь | 16 |
| Карп | 104 |
| Минога | 174 |
| Лягушка (Rana pipiens) | 26 |
| Cазан | 104 |
| растения | |
| Клевер | 14 |
| Тополь | 38 |
| Кукуруза (Zea mays) | 20 |
| Горох | 14 |
| Береза | 84 |
| Ель | 24 |
| Лук (Allium cepa) | 16 |
| Арабидопсис (Arabidopsis thaliana) | 10 |
| Картошка (S.tuberosum) | 48 |
| Ужовник | 48 |
| лилия | 24 |
| Хвощ |
216 |
| Томат | 24 |
| Крыжовник | 16 |
| Вишня | 32 |
| Рожь | 14 |
| Пшеница | 42 |
| Папоротник | ~1200 |
| беспозвоночные | |
| Миксомицеты | 14 |
| Трипаносома | ? |
| Бабочка | 380 |
| Шелкопряд | 56 |
| Протей (Necturus maculosis) | 38 |
| Рак (Cambarus clarkii) | 200 |
| Гидра | 30 |
| Аскарида | 2 |
| Пчела | 16 |
| Муравей (Myrmecia pilosula) | 2 |
| Виноградная улитка | 24 |
| Земляной червь | 36 |
| Речной рак | 116 |
| Малярийный плазмодий | 2 |
| Радиолярия | 1600 |
Наименьшее число хромосом: самки подвида муровьев Myrmecia pilosula имеют пару хромосом на клетку. Самцы имеют только 1 хрососому в каждой клетке.
Наибольшее число: вид папоротников Ophioglossum reticulatum имеет около 630 пар хромосом, или 1260 хромосом на клетку
Верхний предел числа х-м не зависит от количества ДНК которое в них входит: у американской амфибии Amphiuma ДНК в ~30 раз больше, чем у человека, которая помещается в 14 хромосомах. Самая маленькая хромосома амфибии больше самых крупных хромосом человека --> большое количество ДНК может не влиять на увеличение числа хромосом.
Нет верхнего предела ограничивающего количество хромосом: бабочка Lysandra nivescens n=140-141 хромосома.
Существует минимальная масса хромосомы необходимая для расхождения хромосом в митозе - критическая масса. Наличие такой массы может частично объяснить избыточность ДНК.