Медицинская биология
Раздел о научных исследованиях и практической деятельности по исследованию нормальных и патологических процессов в организме человека, а также сохранению и укреплению здоровья людей.
Генетическая уникальность
Преждевременное старение
Прогерия Хатчинсона-Гилфорда - Hutchinson-Gilford progeria syndrome (HGPS)
 Редкое генетическое заболевание, характеризуемое преждевременным старением и увеличением числа сердечных заболеваний. Синдром описан впервые в 1886 году. С тех пор зафиксировано более 100 случаев его проявления. Синдром проявляется в среднем у одного из 8 миллионов новорожденных.
Редкое генетическое заболевание, характеризуемое преждевременным старением и увеличением числа сердечных заболеваний. Синдром описан впервые в 1886 году. С тех пор зафиксировано более 100 случаев его проявления. Синдром проявляется в среднем у одного из 8 миллионов новорожденных.
Первые проявления заболевания появляются в 12-14 месяцев и заключаются в потере волос и отставании в росте. Кроме того, прогерия характеризуется появлением морщинистой кожи, преждевременного атеросклероза, остеопороза, деформаций костей, что выражается в диспропорциях черепа и лица, недоразвитии нижней челюсти и ключицы, смещении бедер, недоразвитие зубов и других патологий (рис.1).
У больных детей начинают проявляться болезни старческого периода, однако их разум развивается в соответствии с их реальным возрастом,
так что их старение нельзя считать абсолютно аналогичным старению здорового человека. Дети с HGPS умирают в среднем в 12-13 лет, обычно от сердечных приступов или кровоизлияний в мозг и, как правило, живут от 8 до 21 года.
Ген LMNA кодирует предшественник ламина А
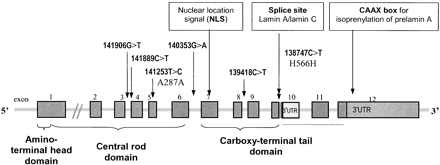
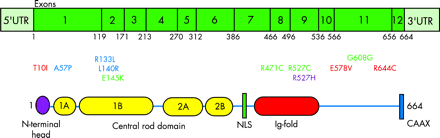
HGPS возникает из-за мутации одного гена LMNA, кодирующего преламин А/C, приводящей к делеции 50 аминокислот в предшественнике белка ламинаА -преламине А, который является структурным белком ядерной мембраны (рис.2, 3).
В нормальных клетках ген LMNA состоит из 25000 пар нуклеотидов, мРНК преламина А состоит из 12 экзонов. В седьмом экзоне кодируется сигнал ядерной локализации (NLS), необходимый для транспортировки белка из цитоплазмы в ядро. В десятом экзоне находится сайт альтернативного сплайсинга ламин А/ламин С. Белок преламина А состоит из 664 аминокислот и несет на С-конце CAAX-мотив (661-664), в котором С-цистеин, А - остаток обычно алифатической
аминокислоты, Х может быть любым остатком. Такой мотив также обнаружен в ламине B1, B2 и у многих других клеточных белков. CAAX мотив запускает три последовательных ферментативных реакции посттрансляционной модификации, приводящие к зрелому ламину А, структурному белку ядерной мембраны:
1. Фарнезилтрансфераза (FTase) добавляет липид С15-фарнезил к тиольной группе цистеина в пределах CCAX мотива.
2.Следующие три аминокислоты (т.е. AAX) удаляются белокпрениловой специфической эндопротеазой. Расщепление белка производят две мембранные эндопротеазы эндоплазматического ретикулума, Zmpste24 and Rce1
3. Вновь образованный фарнезилцистеин метилируется пренилбелковой специфической метилтрансферазой эндоплазматического ретикулума Icmt.
После того как модификации CAAX мотива выполнены, преламин А (в отличие от других CAAX-содержащих белков) подвергается дополнительной модификации. Фрагмент С-концевых 15 аминокислот
(647-661) белка, вместе с метилированным фарнезилцистеином, вырезается металлопротеазой Zmpste24 и деградирует. Оставшая часть является зрелым ламином А (рис.4). Фарнезилирование преламина А важно для узнавания ядерной мембраны. Каждая из трех модификаций преламина А создает гидрофобность С-конца, обеспечивая ассоциацию его с внутренней ядерной мембраной, после чего белок расщепляется.
рис 2. Схема строения гена LMNA
рис 3. Схема строения мРНК и белка преламина А. UTR - нетранслируемый регион, NLS - сигнал ядерной локализации, CAAX - мотив пренилирования.
G608G, E145K и R471C, R527C - мутации приводящие к HGPS (показаны зеленым).
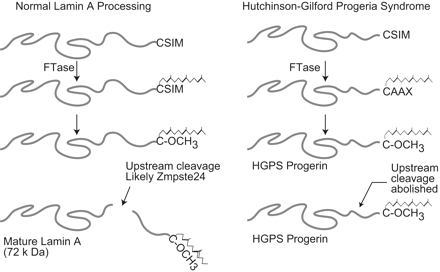
рис 4.
Мутантный ламин
Наиболее часто HGPS происходит при точечных мутациях экзона 11 LMNA, мутация происходит в кодоне 608 и активирует загадочный сайт сплайсинга, приводящий к делеции в 50 аминокислот в рамке считывания преламина А (606-656 аминокислоты), но при этом остается С-концевой CAAX мотив. При этом теряется сайт по которому происходит расщепление белка преламина во время созревания. В нормальных клетках преламин обнаружить не удается, так как он сразу же переводится в зрелый ламин А. Мутантный преламин А, образующийся при HGPS, который называют также прогерин, вмещает CAAX мотив, запускающий фарнезилирование, но делеция в 50 аминокислот предотвращает последующий процессинг в зрелый ламин А, что приводит к накоплению прогерина в нуклеоплазме ядра. Это приводит к нестабильности мембраны: нарушается ее
целостность, появляются характерные выпячивания, увеличивается пористость, что приводит к ускорению гибели клеток.
В экспериментах на культурах клеток фибробластов было показано, что при недостатке Zmpste24 количество преламина А увеличивалось и появлялись изменения характерные для клеток больных прогерией - ядра фибробластов деформированы и содержат многочисленные пузыри.
Преламин А токсичен и уменьшение его уровня по крайней мере до 50% обеспечивает защиту от заболевания HGPS, что может помочь в поиске подхода к лечению этого синдрома.
- S.H. Yang, M.O. Bergo , J.I. Toth, X. Qiao, Y. Hu, S. Sandoval, M. Meta , P. Bendale , M.H. Gelb , S.G. Young, L.G. Fong Blocking protein farnesyltransferase improves nuclear blebbing in mouse fibroblasts with a targeted Hutchinson-Gilford progeria syndrome mutation. PNAS, 2005.
- A.B. Csoka, H. Cao, P. J. Sammak, D. Constantinescu,
G. P. Schatten and R. A. Hegele Novel lamin A/C gene (LMNA) mutations in atypical progeroid syndromes Journal of Medical Genetics 2004; 41:304-308 - B.C. Capell , M.R. Erdos, J.P.Madigan, J. J. Fiordalisi, R. Varga, K. N. Conneely, L.B. Gordon, C.J. Der, A.D. Cox and F.S. Collins, Inhibiting farnesylation of progerin prevents the characteristic nuclear blebbing of Hutchinson-Gilford progeria syndrome PNAS, 2005, no. 36, 12879-12884.
- L.G. Fong, J.K. Ng , M.Meta, N. Cote, S. H. Yang, C.L. Stewart, T. Sullivan, A. Burghardt, S. Majumdar, K. Reue, Martin O. Bergo and S.G. Young Heterozygosity for Lmna deficiency eliminates the progeria-like phenotypes in Zmpste24-deficient mice PNAS, 2004, no. 52, 18111-18116.
Прионы
Прионы - это инфекционные агенты состоящие только из одного сиалогликопротеина PrP 27-30. Они не содержат нуклеиновой кислоты. PrP 27-30 имеет массу 27-30 кДа и содержит 145 аминокислот, гликозилированных по 181 и 197 аминокислотам или около них. С-конец содержит фосфатидилинозитол - гликолипид, содержащий этаноламин, фосфат, мио-инозитол и стеариновую кислоту. Белок выделяется при многих заболеваниях человека и животных повреждающих нервную систему:
Прион - это продукт человеческого гена PrP расположенного в 20 хромосоме. Этот ген состоит из двух экзонов разделенных одним интроном.
Экзон 1 и Экзон 2 транскрибируются независимо и две РНК сшиваются в одну мРНК. Эта мРНК содержит ORF (open reading
fraim) или белок кодирующий район который транслируется в PrP белок. PrP белок является предшественником прионового белка и назван PrP 33-35.
Белок PrP подвергается нескольким пост-трансляционным событиям, приводящим к прионовому белку PrP 27-30:
- Гликозилирование по двум сайтам
- Формирование дисульфидной связи между цистеиновыми остатками
- Удаление N-концевого сигнального пептида
- Удаление С-концевого гидрофобного сегмента
- Присоединение фофсфатидилинозитол гликолипида к С-концу
- Удаление N-концевых 57 аминокислот
В нормальных здоровых клетках образуется только PrP 33-35. В поврежденных клетках из PrP 33-35 образуется PrP 27-30 белок, который запускает реакции образования больших количеств PrP 27-30. Помимо посттрансляционных модификаций, белок PrP 27-30 отличается от белка PrP 33-35 одним аминокислотным остатком. Остаток 178 в PrP 27-30 содержит аспарагин вместо аспартата в случае PrP 33-35. Это отличие приводит к конформационным
изменениям, при которых белок PrP 27-30 меняет структуру а-спирали на b-слой. Такое конформационное изменение белка приводит к следующим эффектам:
- Белок PrP 27-30 становится способным превращать а-спирали белка PrP 33-35 в b-слои и таким образом белок PrP 27-30 "размножается". Именно это уникальное свойство, поколебало основную догму молекулярной биологии, по которой информация передается от ДНК к белку и позволило говорить о передаче информации от белка к белку.
- Белки с b-слоями образуют амилоидные фибриллы (бляшки).
- Амилоидные бляшки повреждают таламические нейроны запуская в них апоптоз (см. обзор Апоптоз)
Прионовые белки накапливаются в клетках ЦНС в течении развития заболевания, вызывая следующие повреждения:
- Увеличение количества астроцитов.
- Истощение дендритов.
- Формирование в коре мозжечка многочисленных вакуолей (губчатая энцефалопатия).
- Амилоидозис - образование амилоидных бляшек в коре мозжечка, таламусе, спинном и головном мозге, в просветах кровеносных сосудов мозга. Эти бляшки состоят из зернистой стекловидой массы покрытой радиально расположенными амилоидными фибриллами.
Примечательно, что для патологии связанные с прионами не характерны симптомы воспаления и жара. Это говорит о том, что иммуная система не распознает прионовые белки.
Симптомы характерные для прионовых заболеваний:
- Длительный инкубационный период (несколько лет).
- Потеря мышечной координации, приводящей к проблемам с хождением, и другими сложными движениями.
- Слабоумие, связанное с потерей памяти.
- Бессонница.
Рак
Канцерогенез
Клетки многоклеточного организма с нарушением систем регуляции клеточного цикла, репарации, клеточной сигнализации или из-за многих других причин могут приобретать способность автономного развития. При этом они размножаются отодвигая здоровые органы и ткани - доброкачественные опухоли или разрушая окружающие ткани - злокачественные опухоли. Злокачественные клетки могут распространяться по организму по кровеностным или лимфотическим сосудам образуя области вторичного поражения - метастазы.
Рак классифицируют по типу тканей из которых он появляется:
Карцинома - рак эпителиальных тканей.
Саркома - рак соединительных тканей, таких как мышечная ткань.
Лейкемия - рак клеток кровеностной системы.
Онкогены -
Канцерогены проникая в клетку вызывают мутации 3-4 онкогенов, или другие повреждения генома, что ведет к образованию опухоли.
Смертность от злокачественных опухолей занимает второе место после заболеваний сердца. Латентный период развития опухоли min 5% продолжительности жизни – мышь 1 месяц, человек – 5 лет и более – осложняет лечение.
Причины рака
канцерогены – 3,4-бензипирен – получен при перегонки каменноугольной смолы – причина рака мошенки трубочистов.
радиация
вирусы –папилломы, гепатитB, герпес; бактерии Helicobacter pylori – воспаление желудка?генетич предрасп к раку; простейшие – Opistorchis filineus – опухоли печени на фоне воспаления
гормоны – повышенное содержание эстрогенов – рак яичников
мутации генов: BRCA-1,2 и p53 – рак молочной ж., RB-ретинобластома, Nf-1,2 и RET – опухоли мозга и щитовидной железы. MTS1 и CDN4 - меланома
Стволовые клетки
Cтволовые клетки классифицированы в соответствии со своей возможностью к дифференцировке как тотипотентные, плюрипотентные и мультипотентные.
Тотипотентные - клетки, способные дифференцироваться в любые клетки организма. Как из одной оплодотворенной клетки вырастает целый организм.
Плюрипотентные - клетки, способные образовывать множество различных клеток, но не целый организм.
Мультипотентные - клетки, способные образовывать клетки тканей из которых они были взяты.
Унипотентные - клетки дающие начало только одному типу клеток.
Клетки развивающегося эмбриона изначально тотипотентны, но теряют это свойство после нескольких клеточных делений, т.е. они дифференцируются. Некоторые из клеток организма, не дифференцируются окончательно, а становятся плюрипотентными, т.е. способны давать лишь некоторые типы клеток целого организма. Тотипотентные клетки эмбриона называют
так же - эмбриональные стволовые клетки (ESC), а плюри- и мультипотентные клетки организма называют - взрослыми стволовыми клетками. Функция первых в организме очевидна, из одной клетки должен развиться целый организм с огромным числом клеточных типов (~200 у человека), каждый из которых выполняет свою функцию. Взрослые стволовые клетки необходимы организму для восполнения погибших клеток в процессе жизни. Взрослые стволовые клетки способны заменять практически все ткани в организме: мозг, костный мозг, кровь, почку, эпителий пищеварительной системы, кожу, сетчатку, мышцы, поджелудочную железу и печень.
Взрослые стовловые клетки способны к самоподдержанию и производству клеток -предшественников, которые затем дифференцируются.
Гематопоэзные стволовые клетки (HSC)
Клетки способные производить все клетки крови находятся в крастном костном мозге. Клетки из которых образуются клетки крови имеют на своей поверхности маркеры CD34, CD59 и Thy1,
по которым могут быть идентифицированы.
Нейральные стволовые клетки (NSC)
Нейрогенез в мозге происходит в двух местах: субвентрикулярная зона (СВЗ), из которой были изолированы первые с.к., и зубчатая извилина. Зрелые нейроны образуются в обонятельной луковице , область в которую мигрируют клетки из СВЗ различными путями называемыми ростральной миграционной системой. СВЗ содержит эпиндимальные клетки и астроциты со схожей ролью с клетками стромы в костном мозге. Эпидимальные клетки и астроциты образуют каналы называемые глиальные трубки по которым происходит миграция нейробластов к обонятельной луковице, где дифференцируются в перигломерулярные или гранулярные нейроны, которые выстраиваются цепочкой. Астроциты в трубках обеспечивают питание клеток.
Известны молекулярные маркеры, позволяющие идентифицировать как стволовые нервные клетки, так и последовательные фазы их развития, - это нестин для ство-ловой клетки, виментин для клетки-предшественника, бета-тубулин для нейробласта,
GFАР (кислый глиальный фибриллярный белок) для клетки, "движущейся" в направлении глиального развития и т. д.
Установлено, что нервные стволовые клетки характеризуются выраженным консерватизмом, так что человеческие стволовые клетки способны мигрировать и развиваться в случае их трансплантации в мозг крысы. Более того, в экспериментах было показано, что даже нервные стволовые клетки дрозофилы способны дифференцироваться в случае их ксенотрансплантации в мозг такого отдаленного таксона, как крыса. Для этой цели были получены трансгенные линии дрозофилы, содержащие человеческие гены, кодирующие нейротрофические факторы NGF, GDNF, BDNF. Человеческие гены были встроены в вектор Саsреr под дрозофилиным хит-шоковым промотором, так что температура тела млекопитающих служила автоматическим активатором соответствующих генов. Для идентификации клеток дрозофилы в геном трансгенных линий был введен ген бактериальной галактозидазы 1асZ, продукт которого легко
выявляется с помощью гистохимической Х-гал окраски. Тем самым нервные клетки ксенотрансплантата легко обнаруживаются среди клеток реципиента или котрансплантата. Оказалось, что нервные стволовые клетки дрозофилы не только выживают, но и мигрируют и дифференцируются в мозге крысы.
Мышечные стволовые клетки (MSC)
Обонятельные стволовые клетки
Дают начало обонятельным клеткам. Располагаются в слизистой носа.
Стволовые клетки печени
В нормальном состоянии клетки печени деляться очень медленно, но под влияниям повреждений или инфекции пролиферация клеток усиливается многократно. Имеется 3 популяции клеток, способных востановить печень.
Эмбриональные стволовые клетки (ESC)
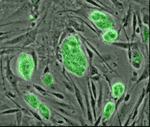 Эмбриональные стволовые клетки получают из внутренней клеточной массы бластоциста от оплодотворения яйцеклетки до ее имплантации, при этом бластоциста
Эмбриональные стволовые клетки получают из внутренней клеточной массы бластоциста от оплодотворения яйцеклетки до ее имплантации, при этом бластоциста
мыши достигает 150 клеток и представляет собой сферу с внешним слоем клеток, полостью бластоцеля заполненной жидкостью и внутренней клеточной массой.
ESC человека могут быть получены пересадкой ядер, называемой так же терапевтическое клонирование. При пересадке ядра соматической клетки донора (например в клетку кожи) в яйцеклетку с удаленным ядром, образуется бластоциста, клетки которой тотипотентны. Стволовые клетки полученные таким образом не отвергаются при пересадке.
ESC могут быть получены из примордиальных клеток из которых образуются яйцеклетки и сперматозоиды.
Классическими маркерами ЭСК являются изозимы щелочной фосфатазы, транскрипционный фактор Осt-4, высокая теломеразная активность и ряд маркеров клеточной поверхности, например GСТМ-2, TRA 1-60, SSЕА-3 и SSЕА-4, распознаваемые моноклональными антителами к специфическим эмбриональным или опухоль-определяющим антигенам. Физиологическое значение большинства маркеров остается неясным,
за исключением Осt-4. Исследования, проведенные на ЭСК и эмбрионах мыши, выявили критическую роль Осt-4 в поддержании тотипотентности ранних эмбриональных клеток и клеток зародышевого пути. Дифференцировка клеток внутренней массы сопровождается понижением уровня Осt-4, а изменение уровня синтеза Осt-4 в ЭСК в свою очередь приводит к потере тотипотентности и переходу к дифференцировке. Кроме Осt-4, имеется еще ряд транскрипционных факторов, синтезируемых в основном недифференцированными ЭСК, например Nanog, который занимает важное место в иерархии факторов, определяющих недифференцированную природу ЭСК, и происхождение.
Маркеры стволовых клеток
Гены "стволовости"
Повышенная экспрессия в стволовых клетках регуляторных генов, таких как НохВ4, Неs-1 или AMLI-ETO приводит к размножению стволовых клеток in vitro и in vivo.
Лечение стволовыми клетками
Первое клиническое применени стволовых клеток началось еще до их открытия. При переливании крови в организм реципиента
попадают стволовые клетки донора, которые внедряются в организм реципиента и дифференцируются. При лейкозах (рак крови) широко применяют обильное переливание крови и пересадку костного мозга - вводят в организм клетки, дающие начало всем клеткам крови. В результате образуются нормальные, не пораженные раком лейкоциты и лимфоциты, что улучшает состояние пациента. К сожалению, при переливании крови или пересадке ткани костного мозга от одного человека к другому может наблюдаться реакция отторжения. Ее пытаются минимизировать, подбирая донора, антигенная структура белков которого сходна с таковой у реципиента. Используют также лекарства, подавляющие иммунный ответ последнего. Однако это может быть опасно, ибо иммунная система обеспечивает очищение организма от инфекционных агентов и время от времени возникающих в нем клеток с измененным геномом; тогда отдельные из них могут малигнизироваться (т.е. превратиться в раковые). Решить проблему тканевой несовместимости можно, вероятно, используя
для пересадки стволовые клетки самого пациента, размноженные вне организма. Очень важно то, что стволовые клетки почти не подвержены злокачественному перерождению, поскольку обладают системой зашиты генома значительно более мощной, чем вступившие на путь специализации. Вот почему ныне из костного мозга больных лейкозом выделяют стволовые клетки и консервируют их в жидком азоте. Затем собственный костный мозг, включая содержащиеся в нем опухолевые клетки, подавляют облучением или цитостатиками (лекарствами, блокирующими рост и размножение клеток), после чего восстанавливают кроветворение и иммунитет, пересаживая сохраненные в азоте стволовые клетки, из которых образуется полный набор нормальных клеток крови. Такую замену производят не только при лейкозах, но и при других опухолях, если лечение включает курсы радио- или химиотерапии.
В настоящее время для каждого рождающегося человека может быть создан запас стволовых клеток, по свойствам близких к эмбриональным и генетически тождественных всем его другим
клеткам. Для этого при родах нужно собирать содержащую их пуповинную кровь и хранить ее (или выделенные из нее клетки) в жидком азоте вплоть до момента, когда она понадобится для пересадки.
Лечение заболеваний сердца
Инфаркт миокарда вызывается спазмом или закупоркой артерий, питающих мышцу сердца. Пораженные сосуды удаляют, а для восстановления кровообращения применяют шунтирование. Однако это не обеспечивает восстановление погибшего участка сердечной мышцы. Если зона инфаркта обширна, то сократительная функция сердца значительно страдает, и больной не может вести нормальный образ жизни. Пересадка препаратов стволовых клеток, полученных из его костного мозга, а также производных эмбриональных или фетальных клеток путем вливания их суспензии в общий кровоток или инъекцией непосредственно в миокард по границе зоны омертвления мышцы (последнее делается в процессе шунтирования) приводит к частичному или полному восстановлению структуры и функции миокарда и значительно улучшает качество жизни
больного.
Лечение заболеваний костной системы
Введение полученных из стволовых клеток остеобластов (предшественники клеток кости) в зону перелома значительно ускоряет процесс сращивания кости, а введение хондробластов (предшественники клеток хряща) в суставную сумку стимулирует регенерацию хряща на суставных поверхностях.
Лечение рака
Stem cells have acquired a golden glow in the past few years
as a possible tool for reversing the damage of various organs.
The prediction was that stem cell transplants, whether derived
from embryonic tissue or from adult cells that retain
the fl exibility to develop into various tissues, will someday
repair hearts crippled by heart attacks or brains under attack
by Alzheimer’s or Parkinson’s disease. But the very qualities
that make these cells so attractive to medicine, especially
their capacity to replicate ad infi nitum, also hint at a
dark side. Evidence suggests that they may be the source of
the mutant cells that give rise to cancerous tumors (also reviewed
in [115]. In studies of cells in blood cancers such as
leukemia and in breast and brain cancers, cells called “cancer
stem cells” have been identifi ed. The fi ndings have raised
the possibility that the mutations that drive cancer development
may have originated in the body’s small supply of naturally
occurring stem cells. Cancer stem cells resemble these
normal cells in several ways. In particular, both types are selfrenewing.
Thus, when they divide, one of the daughter cells
differentiates into a particular cell type that eventually stops
dividing, but the other retains its stem cell properties, including
the ability to divide in the same way again. Therefore,
it is possible that cancer stem cells, which form only a small
proportion of the total tumor cell population, are the only
tumor cells with the capacity to keep tumors growing.
In the early 1990s, Dick and colleagues [116,117] used a
model to study the development of human hematopoietic
stem cells which give rise to various types of blood cells. The
model is based on an extremely immunodefi cient mouse
strain, the NOD/SCID mouse. The animals were irradiated
to destroy their bone marrow and then human stem cells
were introduced to see if they would produce a new complement
of blood cells. After showing that normal human
hematopoietic stem cells could do this, Dick and his team
used the approach to study the cancer-causing power of
acute myeloid leukemia (AML) cells freshly harvested from
human patients [118]. By a progressive dilution of a known
number of leukemia cells, it was possible to establish that
only a very rare AML cell, about one in a million, had the
ability to reproduce the disease in the animals. Because this
was a much smaller fraction of cells than that necessary to
form colonies in culture, the result indicated that the simple
ability to grow did not equate with the ability to develop
into leukemia in living animals. Thus one could speculate
that the leukemia-initiating cells had a greater developmental
potential than the vast majority of clone-forming cells
and might even be stem-like cells. Subsequently, the leukemia-
initiating cells were characterized according to surface
protein markers that distinguish the various cell types of the
hematopoietic system. The leukemia-initiating cells turned
out to belong to an exclusive group. They were positive for
the CD34 marker and negative for CD38, the same as human
hematopoietic stem cells, and did not carry the markers
of more mature cells. The cancer cells’ resemblance to
normal stem cells holds up even though AML is a heterogeneous
disease, with several different subtypes depending
on which genetic abnormalities the patients’ cells carry.
Dick and his colleagues characterized the leukemia-initiating
cells from the various AML subtypes and found that all
belonged to that same CD34+/CD38– class. When put into
NOD/SCID mice, however, each cell type produced a leukemia
identical to that in the patient from which it had originally
been isolated. A plausible conclusion from this study
is that the initial mutations that gave rise to the leukemias
arose in normal stem cells, causing them to take the wrong
developmental pathway.
Another line of evidence suggesting that cancers originate
from stem cells comes from studies of the biological machinery
underlying self-renewal. Normal and cancer stem
cells show some striking similarities. Recently, for example,
researchers have shown that the genes Bmi-1 and Wnt, both
of which can cause cancer when mutated, are needed for
self-renew in normal and cancer stem cells (also reviewed
in [119]. The Bmi-1 gene participates in normal hematopoietic
development, and its malfunction has been linked to
AML. A study reported by Park and collaborators [120] and
another by Lessard and Sauvageau [121] link the gene to
self-renewal. To test whether cells missing Bmi-1 can selfrenew,
the researchers transplanted stem cells from Bmi-1
knockout mice into normal mice that had been irradiated
to destroy their bone marrow. The stem cells produced a
normal complement of blood cells, but only for very short
period of time. After eight weeks, blood cells derived from
the transplanted cells had almost disappeared, and when
bone marrow taken from the animals was put into a second
series of mice, no Bmi-1-defi cient blood cells could be detected.
Bmi-1 is also needed for the self-renewal of leukemia
cells [121]. In previous reports, Sauvageau and collaborators
revealed that they could cause an AML-like disease
in mice by introducing two oncogenes, Meis1a and Hoxa9,
into the bone marrow cells of the animals [122]. This result
shows that without Bmi-1, leukemia stem cells die out,
just as normal stem cells do. The Wnt gene is likewise the
focus of a great deal of research by both cancer researchers
and developmental biologists. The protein encoded by the
gene normally controls cell fate decisions during the development
of many of the body’s tissues. It exerts its effects by
binding to, and thus activating, a receptor on the cell surface
membrane. This in turn sets off a series of changes inside
the cell, culminating in the activation of genes governing
cell division and differentiation. Details of these processes
however, are still poorly understood and require further
intensive research both in the area of stem cells, including
lessons learned from the biology of embryonic stem cells,
as well as from the biology of various cancer cell lines and
various types of cancer.
Лечение заболеваний нервной системы
Сокращения.
in vivo - в живом организме
in vitro - в пробирке