Трансляция
Трансляция
Общие сведения
Трансляция - это процесс, в результате которого рибосомы считывают генетическую информацию матричных РНК и создают белковый продукт в соответствии с этой информацией.
Специфические молекулы транспортрых РНК (тРНК) служат посредниками между кодом мРНК и конечной белковой последовательностью. В их состав входит последовательность, узнающая код мРНК и соответствующая этому коду аминокислота.
События трансляции разделяют на последующие события: инициацию, элонгацию и терминацию. На стадии инициации рибосома связывает мРНК и первая аминокислота присоединяется к рибосоме. Во время элонгации происходит рост полипептидной цепи. На стадии терминации рибосома отделяется от мРНК и процес трансляции заканчивается. У прокариот и эукариот процессы трансляции схожи, но имеются и существенные различия.
Трансляция происходит в цитоплазме, где находятся рибосомы. В зависимости от дальнейшего преднозначения синтезируемых белков, они могут образовываться либо в цитозоле, либо на поверхности шероховатого эндоплазматического ретикулума.

Полипептидные цепи синтезируются однонаправленно: с амино-конца к карбокси-концу.
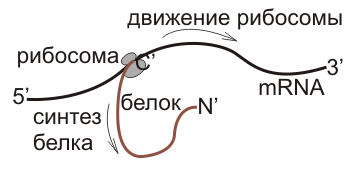
При инициации первая и вторая молекулы аминоацил-тРНК спариваются с первыми двумя кодонами мРНК. Далее трансляция продолжается в направлении 5'–>3' кодон за кодоном до тех пор, пока не достигнет стоп-сигнала, расположенного сразу же за кодоном, детерминирующим С-концевую аминокислоту.
К сожалению, список литературы отсутствует.
Генетический код
К сожалению, список литературы отсутствует.
Трансляция у эукариот
Вместо комплементарного РНК-РНК узнавания, в которое вовлечена прединициирующая последовательность Шайна-Дальгарно прокариотических мРНК, эукариотические мРНК узнаются эукариотическими рибосомами по кэпированному 5'-концу с обязательным участием белка, например, eIF-4F инициаторного фактора ( Rhoads, 1988 ). Предполагается, что этот белок участвует в расплавлении вторичных структур 5'- областей мРНК, облегчая их связывание с малыми субчастицами рибосом. В отличие от прокариот, эукариотическая мРНК образует комплексы с белками ( мРНП , или мессенджер-рибонуклеопротеиды, или информосомы ), что обусловливает ее метаболическую стабильность. Вследствие этого у эукариот отсутствует постоянная интенсивная деградация и интенсивный ресинтез мРНК, которые, как правило, моноцистронны и имеют специфически модифицированный (кэпированный) 5'-конец. Все это обусловливает целый ряд особенностей инициации трансляции и ее регуляции у эукариотических организмов. Естественно, что метаболическая стабильность эукариотической мРНК делает регуляцию на уровне трансляции особенно важной в общей картине регуляции биосинтеза белка ( Спирин, 1986 ).
К сожалению, список литературы отсутствует.
Трансляция у прокариот
 Трансляция бактерии E.coli наиболее изучена
Трансляция бактерии E.coli наиболее изученаСинтез белка происходит на рибонуклеопротеиновом комплексе - рибосоме, в процессе трансляции mRNA. Рибосома состоит из большой и малой субъединиц, которые соединены в области инициации трансляции (translation initiation region -TIR) mRNA во время стадии инициации трансляции. Во время элонгации рибосома скользит вдоль mRNA и синтезирует полипептидную цепь. Элонгация продолжается до тех пор, пока рибосома не достигает стоп-кодона на mRNA - терминация трансляции. После терминации рибосома отделяется от синтезированного полипептида и способна снова повторить цикл трансляции mRNA.
Каждая стадия трансляции имеет свои регуляторные факторы, но у эукариот этих факторов гораздо больше, чем у прокариот.
Инициация
Инициация
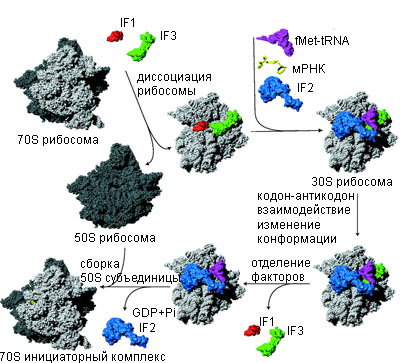 Последовательность инициации трансляции у бактерии. 30S и 50S рибосомные субъединицы показаны светлым и темным серым цветом. [Laursen, et al. 2005]
Последовательность инициации трансляции у бактерии. 30S и 50S рибосомные субъединицы показаны светлым и темным серым цветом. [Laursen, et al. 2005]Рибосомы прокариот инициируют трансляцию на мРНК уже во время транскрипции. Время необходимое для посадки рибосом порядка секунд, хотя это зависит от каждой мРНК. Рибосомы транслируют мРНК со скоростью приблизительно 12 аминокислот в секунду.
В инициации трансляции участвуют: рибосома, аминоацилированная и формилированная тРНК (fMet-tRNAfMet), мРНК и три белковых инициирующих фактора IF1, IF2 и IF3.
Бактериальная 70S рибосома состоит из большой 50S и малой 30S субъединицы. Имеется три tRNA связывающих сайта аминоацил - aminoacyl (A), пептидил - peptidyl (P), и сайт выхода - exit (E). Присоединение фактора IF3 к 30S рибосомной субъединице обеспечивает распад рибосомы на субъединицы. Фактор инициации IF1 связывается с A-сайтом 30S рибосомной субъединицы и служит инициатором присоединения tRNA к рибосомному P-сайту блокируя A-сайт. IF1 стимулирует активность IF3 и также распад рибосомных субъединиц.
После распада субъединиц, IF2, mRNA и fMet-tRNAfMet соединяются с 30S рибосомной субъединицей. Последовательность Шайно-Дальгарно (Shine-Dalgamo -SD) mRNA взаимодействует с anti-SD последовательностью 16S rRNA и инициирующий кодон присоединяется в Р-сайте рибосомы. Инициирующие факторы, особенно IF3, способствуют этому присоединению.
Инициаторная tRNA устанавливается в P-сайте 30S рибосомной субъединицы в три шага не зависимо от кодона, зависимо от кодона и fMet-tRNAfMet присоединение.
Все три шага обеспечиваются фактором IF2, который взаимодействует с fMet-tRNAfMet на рибосоме. IF3 стабилизирует присоединение fMet-tRNAfMet к рибосомному P-сайту и стабилизирует кодон-антикодон взаимодействие.
30S преинициаторный комплекс состояций из 30S рибосомной субъединицы, трех инициаторных факторов, mRNA в стартовой позиции, где fMet-tRNAfMet связана кодон независимо. Такой относительно нестабильный комплекс подвергается конформационному изменению, что обеспечивает кодон-антикодон взаимодействие и формирует более стабильный 30S инициаторный комплекс. Инициаторные факторы IF1 и IF3 отсоединяются, тогда как IF2 фактор стимулирует взаимодействие с 50S рибосомной субъединицей. После сборки рибосомы IF2 покидает комплекс. Во время этого процесса GTP связанный с IF2 гидролизуется до GDP и Pi. Вновь образованный 70S инициаторный комплекс, содержащий fMet-tRNAfMet как субстрат для пептидилтрансферазного центра 50S рибосомной субъединицы готов к вступлению в фазу элонгации трансляции.
Факторы инициации: IF-1, IF-2, IF-3 - белки временно связывающиеся с рибосомой, необходимые для инициации.
Этапы инициации трансляции
:
1. Факторы инициации IF-1 и IF-3 связываются с 30S-субчастицей, что обеспечивает ее взаимодействие с IF-2, инициаторной формилметиониновой-тРНК (Fmet-тРНКFMet) и GTP.
2. При связывании инициаторных белков IF-1 и IF-2 с 30S-субчастицей происходит диссоциация 70S-рибосомы на две субъединицы.
3. Комплекс 30S-субъединицы со всеми факторами инициации и Fmet-тРНКFMet связывается с 5'-концом мРНК вблизи кодона AUG и узнает. AUG-кодон мРНК.
Связывание 30S-субчастицы с мРНК находится под строгим контролем нуклеотидной последовательности, расположенной примерно
за 10 нуклеотидов до 5'-конца инициаторного кодона. Взаимодействию способствует комплементарное спаривание этой богатой пуринами по следовательности из 5-8н, называемой последовательностью Шайна-Дальгарно, с полипиримидиновым участком, находящимся вблизи 3'-конца 16S-pPHK.
4. Формирование полноценного функционального комплекса инициации завершается ассоциацией 50S-субчастицы с преинициаторным комплексом. При ассоциации 70S-рибосомы образуются два активных центра: Р- и А-участки. Fmet-TPHKFMet занимает Р-участок.
5. С образованием функциональной 70S-субчастицы отделяются все три белка инициации.
Элонгация
Факторы элонгации: EF-Tu и EF-Ts - белки связывающиеся с рибосомой, необходимые для элонгации трансляции.
В процессе инициации образуется 70S-рибосома связанная с мРНК, в Р-центре которой находится Fmet-тPHKFMet
Для образования первой пептидной связи необходимо, чтобы
аминоацил-тРНК, соответствующая следующему кодону, заняла А-центр.
Этапы элонгации трансляции:
1. EF-Tu-GTP связывает все аминоацил-тРНК, кроме Fmet-тPHKFMet, и доставляет их к А-центру комплекса 70S-рибосома-мРНКАминоацил-тРНК связывает EF-Tu и GTP. Образовавшийся комплекс (аминоацил-тРНК-[ЕF-Тu-GТР]) доставляет аминоацил-тРНК к А-участку. GTP гидролизуется, и комплекс (EF-Tu-GDP) отделяется от рибосомы. EF-Ts восстанавливает EF-Tu-GDP.
2. Когда оба участка, А и Р, заняты, пептидилтрансферазная активность 50S-субчастицы катализирует перенос группы Fmet с ее тРНК на аминогруппу аминоацил-тРНК, находящейся в А-участке. В результате в А-участке оказывается дипептидил-тРНК, а в Р – свободная тРНК.
3. тРНК освобождает Р-участок, образовавшаяся дипептидил-тРНК переместиться на него, а новый кодон должен быть готов к тому, чтобы занять освободившийся А-участок. Все эти процессы
осуществляются с помощью EF-G при GTP-зависимой транслокации рибосомы.
4. Теперь новый кодон, занявший А-сайт, готов к спариванию с родственной аминоацил-тРНК. Сразу после связывания аминоацил-тРНК с А-
участком высвобождается комплекс EF-Tu-GDP и происходит регенерация функционально активного EF-Tu-GTP. При этом EF-Tu-GDP взаи- модействует с белком EF-Ts, что приводит к отделению GDP и образованию комплекса EF-Tu•EF-Ts. Далее EF-Tu•EF-Ts взаимодействует с GTP, происходит регенерация EF-Tu-GTP и отделение EF-Ts, и оба соединения оказываются готовыми к следую- щему циклу.
Для прочтения следующего кодона и удлинения полипептидной цепи еще на одну аминокислоту вся серия реакций должна повториться.
При образовании каждой пептидной связи расходуется энергия, равная четырем энергетическим эквивалентам (если за один эквивалент принять энергию образования фосфатной связи): два эквивалента АТР потребляются при аминоацилировании тРНК и два эквивалента GTP-
в каждом цикле элонгации.
2. При инициации трансляции IF-2 узнает Fmet-тРНКFMet среди всех других аминоацил-тРНК, a EF-Tu отличает met-тРНКF Met от
Fmet-тРНКM Met при внедрении в А-участок.
3. Факторы элонгации EF-Tu и EF-G то присоединяются, то отделяются от рибосомы в зависимости от того, связаны ли они с GTP или с GDP соответственно.
4. Растущая полипептидная цепь всегда соединена своим карбоксильным концом с тРНК, которая соответствует С-концевой аминокислоте в растущей полипептидной цепи.
5. Пептидилтрансфераза катализирует формирование пептидных связей между карбоксильным концом растущей цепи и аминогруппой аминоацил-тРНК.
Терминация
Факторы терминации:
RF-1 вызывает отделение полипептидной цепи при считывании кодонов UAA и UAG;
RF-2 действует аналогичным образом при считывании UAA и UGA,
EF-3 может облегчить работу двух других факторов.
Этапы терминации трансляции:
1. В А-участке оказывается один из трех терминирующих кодонов – UAG, UAA или UGA. Из-за отсутствия тРНК, отвечающих этим кодонам,полипептидил-тРНК остается связанной с Р-участком.
2. RF-1 и RF-2 катализируют отсоединение полипептидной цепи от тРНК, отделение их обоих от рибосомы, а 70S-рибосомы – от мРНК.
RF-1 узнает в А-участке кодон UAA или UAG; RF-2 включается в том случае, когда в А-участке оказы-вается UAA или UGA;
RF-3 облегчает работу двух других факторов. Если терминирующим кодономявляется UAA, то эффективность процесса терминации оказывается наибольшей, поскольку этот кодон узнают оба фактора – RF-1 и RF-2. Однако, каким бы из стоп-кодонов ни обеспечивалась терминация,ее эффективность зависит от фланкирующих эти кодоны последовательностей в мРНК.
Когда расстояние от рибосомы до сайта инициации достигнет величины 100–200 нуклеотидов, в этом сайте может произойти новая инициация трансляции. Таким образом на одной мРНК
может находится несколько транслирующих рибосом - полирибосомы (рис)
Рибосомы
Характерискика рибосом
 Рибосомы
Рибосомы
эукариот: 80S, размер - 22x32 нм,
M ~4.5 млн.Да состоит из двух субъединиц.
Большая субъединица М=3.0млн.Да, 60S
[1rRNA 5S (~120н), 1рРНК 5.8S (~160н), 1rRNA 28S (4800н),
45-50 белковых молекул].
Малая субъединица
М=1.5 млн.Да, 40S [1rRNA18S (1900н), 30-35
белковые молекулы].
В цитоплазме эукариотической клетки содержится ~10 млн. рибосом
эукариотического типа.
Рибосомы прокариот:
70S, размер - 21x29 нм, М ~2.8 млн.Да,
состоит из двух субъединиц.
Большая субъединица М=1.8млн.Да 50S
[1rRNA 23S(~2904н), 1rRNA 5S(~120н), 34 белковые молекулы
(L1-L34)].
Малая субъединица М=1.0млн.Да 30S
[1rRNA 16S (~1542н), 21 белковые молекулы (S1-S21)].
В клетке E.coli содержится ~15тыс. рибосом, что составляет
– 1/4 сухой массы клетки. Рибосомы прокариотического типа
присутствуют в митохондриях и пластидах эукариот.
Малые и большие субъединицы могут диссоциировать на составляющие
РНК и белки и самособираются при определенных условиях.
Строение рибосом
Рибосома имеет два участка для связывания тРНК:
Р-центр (пептидил-тРНК-связывающий центр)
- связывание тРНК присоединенной к растущей полипептидной
цепи.
А-центр (аминоацил-тРНК-связывающий участок)
- связвает тРНК несущую следующую добавляемую аминокислоту,
располагается на большой субъединице рибосомы.
Аcn
центр
пептидилтрансфераза –
образует пептидные связи между актами, прочно связывается
с рибосомой.
рибосома
р эукариот 22x32 нм, M~4.5 млн.Да 80S. Большая субъед М=3.0млн.Да, 60S [1rRNA 5S (~120н), 1рРНК 5.8S (~160н), 1rRNA 28S (~5 тыс.н), ~45 белков]; малая субъед М=1.5 млн.Да, 40S.
1rRNA18S (~2 тыс.н),~33 белка] | в цитоплазме Eu ~10 млн.р эукариотич типа |
р прокариот: 21x29 нм, М ~2.8 млн.Да, 70S | большая субъед М=1.8млн.Да 50S[1RNA 23S(~3200н), 1rRNA 5S(~120н), 34белка]; малая субъед М=1.0млн.Да 30S[1rRNA 16S (~1600н), 21 белок] | E.coli ~15тыс р – 1.4 сухой m кл | р прокариотич типа присут в митох и пластидах Eu |
| P-центр пептидил-тРНК-связывающий центр, А-центр большой субъед. р – аминоацил-тРНК-связывающий участок, Аcn центр | пептидилтрансфераза – образ. пептидные связи м-у актами, прочно связан с р | р прокариот мельче и сод меньше компонентов
мРНК [кэп | 5’-НТО | AUG | транслируемая область | стоп 3’-НТО | поли(А)]
инициация сканирование РНК малой субъединицой рибосомы | связывание со стартовым (инициирующим) кодоном AUG-5’ конца – сборка рибосомы | инициаторный комплекс, факторы инициации | Первой к мРНК присоед малая субъед. р связанная с инициаторной-тРНК узнающей AUG и несущей метионин. Процесс катализируется фактором инициации 2 IF2 – фосфорилирование одной из трех его субъед. снижает активность ф-та – контроль белкогого синтеза (незрелые эритроциты) | элонгация 5’?3’ | транслокация – возвращение пустой тРНК в цитоплазму | транслокация рибосомы вдоль мРНК сопровожд. конформационными изменениями с затратой энергии GTP (4GTP вцелом на 1 пепт. связь) | кодон мРНК спаривается с антикодоном тРНК | карбоксильный конец растущего полипептида связан ковалентно с тРНК – пептидил-тРНК | образ. полисомы | терминирующий кодон (стоп-кодон) UAA, UAG, UGA – диссоциация рибосомы – терминация | фактор освобождения-белок связ с стоп-кодоном и меняет активность пептидилтрансферазы кот присоед к пептидил-тРНК Н2О и полипептид отделяется от тРНК и выходит из р | Цикл элонгации составляет 1/20 сек – белок в 300 акт синтезируется за 20 сек Ecoli
К сожалению, список литературы отсутствует.
Транспортная РНК
70-90Н | вторичная стр-ра- клеверный лист | CCA 3' const для всех tRNA |к концевому аденозину присоед акта |
наличие тимина, псевдоуридина-пси, дигироуридина ДГУ в D-петле - защита от рибонуклеаз ? долгоживущие | Разнообразие первичных структур tРНК - 61+1 - по кол-ву кодонов + формилметиониновая tРНК, у кот антикодон такой же, как у метиониновой tРНК. Разнообразие третичных структур - 20 (по кол-ву аминокислот) | рекогниция - образование ковалентной связи м-у tРНК и актой | аминоацил-тРНК-синтетазы присоединяют акты к тРНК
Функция тРНК заключается в переносе аминокислот из цитоплазмы в рибосомы, в которых происходит синтез белков.
тРНК связывающие одну аминокислоту называются изоакцепторными.
Всего в клетке одновременно существует 64 различных тРНК.
Каждая тРНК спаривается только со своим кодоном.
Каждая тРНК распознает свой собственный кодон без участия аминокислоты. Связавшиеся с тРНК аминокислоты химически модифицировали, после чего анализировали получившийся полипептид, который содержал модифицированную аминокислоту. Цистеинил-тРНКCys (R=CH2-SH) восстанавливали до аланил-тРНКCys (R=CH3).
Большинство тРНК, не зависимо от их нуклеотидной последовательности, имеют вторичную структуру в форме клеверного листа из-за наличия в ней трех шпилек.
Особенности структуры тРНК
На 3'-конце молекулы всегда находятся четыре неспаренных нуклеотида, причем три из них – это обязательно ССА. 5'- и 3'-концы цепи РНК образуют акцепторный стебель. Цепи удерживают-ся вместе благодаря комплементарному спарива-нию семи нуклеотидов 5'-конца с семью нуклеотида-ми, находящимися вблизи 3'-конца. 2. У всех моле-кул имеется шпилька T?C, обозначаемая так пото-му, что она содержит два необычных остатка: рибо-тимидин (Т) и псевдоуридин (?). Шпилька состоит из двухцепочечного стебля из пяти спаренных осно- ваний, включая пару G-C, и петли длиной семь нуклеотидов. Тринуклеотид Т?С всегда расположен
в одном и том же месте петли. 3. В антикодоновой шпильке стебель всегда представлен семью спарен-
ными основаниями. Триплет, комплементарный родственному кодону,– антикодон – находится в пет-
ле, состоящей из семи нуклеотидов. С 5'-конца антикодон фланкируют инвариантный остаток ура-
цила и модифицированный цитозин, а к его 3'-концу примыкает модифицированный пурин, как правило
аденин. 4. Еще одна шпилька состоит из стебля длиной три-четыре пары нуклеотидов и петли варь-
ирующего размера, часто содержащей урацил в вос-становленной форме – дигидроурацил (DU). Наиболее сильно варьируют нуклеотидные по-следовательности стеблей, число нуклеотидов меж-ду антикодоновым стеблем и стеблем Т?С (вариа-бельная петля), а также размер петли и локализация остатков дигидроурацила в DU-петле.
[Сингер, 1998].
Третичная структура тРНК
L-образная структура.
Присоединение аминокислот к тРНК
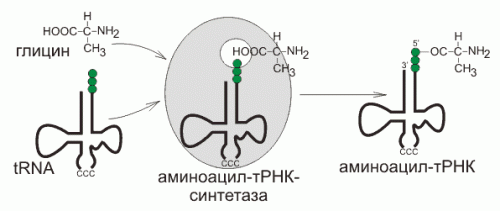 Для того чтобы аминокислота могла образовывать полипептидную цепь она должна присоединиться к тРНК с помощью фермента аминоацил-тРНК-синтетазы. Этот фермент образует ковалентную связь между карбоксильной группой аминокислоты и гидроксильной группой рибозы на 3’-конце тРНК при участии АТФ. Аминоацил-тРНК-синтетаза узнает специфический кодон не из-за наличия антикодона на тРНК, а по наличию специфического сайта узнавания на тРНК.
Для того чтобы аминокислота могла образовывать полипептидную цепь она должна присоединиться к тРНК с помощью фермента аминоацил-тРНК-синтетазы. Этот фермент образует ковалентную связь между карбоксильной группой аминокислоты и гидроксильной группой рибозы на 3’-конце тРНК при участии АТФ. Аминоацил-тРНК-синтетаза узнает специфический кодон не из-за наличия антикодона на тРНК, а по наличию специфического сайта узнавания на тРНК.
Всего в клетке имеется 21 различных аминоацил-тРНК-синтетаз.
Присоединение происходит в две стадии:
1. Карбоксильная группа аминокислоты присоединяется к а-фосфату АТФ. Полученный нестабильный аминоацил-аденилат стабилизируется связываясь с ферментом.
2. Перенос аминоацильной группы аминоацил-аденилата на 2’ или 3’-OH-группу концевой рибозы тРНК
Некоторые аминоацил-тРНК-синтетазы состоят из одной полипептидной цепи, другие – из двух или четырех идентичных цепей, каждая молекулярной массой от 35 до 115 кДа. Некоторые димерные и тетрамерные ферменты состоят из субъединиц двух типов. Четкой корреляции между размером молекулы фермента или характером его субъединичной структуры и специфичностью не существует.
Специфичность фермента определяется его прочным связыванием с акцепторным концом тРНК, DU-участком и вариабельной петлей. Некоторые ферменты, по-видимому, не распознают антикодоновый триплет и катализируют реакцию аминоацетилирования даже при измененном антикодоне. Однако отдельные ферменты проявляют пониженную активность по отношению к таким модифицированным тРНК и при замене антикодона присоединяют не ту аминокислоту.
70-90н | вторичная стр-ра- клеверный лист | CCA 3' const для всех tRNA |к концевому аденозину присоед акта |
наличие тимина, псевдоуридина-пси, дигироуридина ДГУ в D-петле - защита от рибонуклеаз ? долгоживущие | Разнообразие первичных структур tРНК - 61+1 - по кол-ву кодонов + формилметиониновая tРНК, у кот антикодон такой же, как у метиониновой tРНК. Разнообразие третичных структур - 20 (по кол-ву аминокислот)
Имеются два вида тРНК связывающие метионин тРНКFMet и тРНКMMet у прокариот и, тРНКIMetи тРНКMMet - у эукариот. К каждой тРНК добавляется метионин с помощью соответствующих аминоацил-тРНК-синтетез. метионин присоединенный к тРНКFMet и тРНКIMet формилируется ферментом метионил-тРНК-трансформилазой до Fmet-тРНКFMet. тРНК нагруженные формилметионином узнают инициаторный кодон AUG.
К сожалению, список литературы отсутствует.