Рекомбинация ДНК
Рекомбинация ДНК
Гомологичная рекомбинация
 Общая рекомбинация при согласованном внесении разрывов и воссоединении цепей двух спиралей ДНК с образованием протяженных гетеродуплексных областей. Чтобы могла произойти рекомбинация между двойными спиралями, представленная на, каждая из четырех цепей должна быть разорвана и затем соединена с новым партнером. Соответствующие цепи обоих линейных гомологичных дуплексов ДНК надрезаются и свободные концы одной спирали спариваются с комплементарными участками другой. Перекрест стабилизируется сшиванием концов донорных цепей со свободными концами реципиентных спиралей. Точка перекреста обменивающихся цепей перемещается вдоль спиралей – процесс, называемый миграцией ветви (е). При этом происходит одновременное расхождение цепей исходных спиралей и их реассоциация с новыми партнерами с образованием дочерних дуплексов. Структуры д и е, а также ж называются структурами Холлидея по имени исследователя, впервые их
Общая рекомбинация при согласованном внесении разрывов и воссоединении цепей двух спиралей ДНК с образованием протяженных гетеродуплексных областей. Чтобы могла произойти рекомбинация между двойными спиралями, представленная на, каждая из четырех цепей должна быть разорвана и затем соединена с новым партнером. Соответствующие цепи обоих линейных гомологичных дуплексов ДНК надрезаются и свободные концы одной спирали спариваются с комплементарными участками другой. Перекрест стабилизируется сшиванием концов донорных цепей со свободными концами реципиентных спиралей. Точка перекреста обменивающихся цепей перемещается вдоль спиралей – процесс, называемый миграцией ветви (е). При этом происходит одновременное расхождение цепей исходных спиралей и их реассоциация с новыми партнерами с образованием дочерних дуплексов. Структуры д и е, а также ж называются структурами Холлидея по имени исследователя, впервые их
предложившего. Структуры Холлидея могут переходить в рекомбинантные двойные спирали путем внесения разрыва и воссоединения цепей двумя альтернативными способами. Один способ состоит в разрезании и воссоединении перекрещивающихся цепей. Два реципрокных продукта л и м могут образоваться, если разрыв и последующее воссоединение цепей произойдут в точке перекреста в структурах е и д или по линии пересечения четырех цепей в изомерной структуре Холлидея и. Размер обменивающихся фрагментов зависит от расстояния, на которое произошла миграция ветви до акта рекомбинации. Альтернативные продукты н и о образуются в том случае, если структура Холлидея з переходит в результате разрыва в к. В основе рекомбинации данного типа лежит гомологичное спаривание цепей, принадлежащих двум разным спиралям ДНК, поэтому скорее всего она произойдет в том месте, где такое спаривание возможно a priori и где гомологичность последова тельностей достаточно велика, чтобы могла произойти миграция
ветви в рамках структуры со скрестившимися цепями. Отсюда можно понять, почему общая, или гомологичная, рекомбинация происходит также между двумя повторами в пределах одной молекулы ДНК или между аллельными и неаллельными элементами одной и той же последовательности в двух разных хромосомах.
В ходе миграции ветви при спаривании цепей,принадлежащих разным спиралям, образуются гетеродуплексы. В таких гетеродуплексах в пределах сегмента между сайтом начала образования структуры Холлидея и сайтом кроссинговера может содержаться по одному или более ошибочно спаренных оснований. Они удаляются так же, как любые модифицированные основания при репарации ДНК. Однако, поскольку удалено может быть любое из ошибочно спаренных оснований, в обеих рекомбинантных спиралях в данном сайте могут оказаться одинаковые пары оснований, т.е. рекомбинация для этого сайта окажется нереципрокной . Таким образом, каждая из рекомбинантных спиралей может быть похожа на любой
из начальных дуплексов в тех позициях, где исходно они различались.
Общая рекомбинация с образованием двухцепочечного разрыва.
Альтернативный механизм общей рекомбинации включает образование двухцепочечного разрыва в одном из дуплексов-партнеров. Далее с помощью экзонуклеаз в месте разрыва образуется брешь. При спаривании 3'-одноцепочечного конца бреши с комплементарной цепью интактной спирали в последней образуется петля. Размер этой петли увеличивается по мере того, как ДНК-полимераза наращивает 3'-конец «вклинившейся» цепи. В итоге другой одноцепочечный конец бреши спаривается с комплементарной последовательностью в перемещающейся петле. В результате такого спаривания образуется система «праймер матрица», и ДНК-полимераза синтезирует недостающую цепь, заполняя брешь. Лигирование двух растущих концов с исходными цепями приводит к образованию двойной структуры Холлидея (т.е. структуры, в которой две спирали объединены двумя перекрестами,
по одному на каждом конце бреши). Миграция ветви в одном или обоих перекрестах передвигает оба места сцепления в любом направлении, при этом в участках, фланкирующих брешь, могут возникать ошибки. Разделение таких структур может идти двумя способами – с перекрестом и без него , с образованием четырех дуплексов.
Необходимо отметить некоторые особенности этого механизма. Образование ошибочных пар (гетеродуплексов) в районах, фланкирующих брешь, обусловливает получение как реципрокных, так и нереципрокных рекомбинаций между генетическими маркерами. Если двухцепочечный разрыв происходит вблизи (или в пределах) участка, где между спиралями имеются различия (замены оснований, делеции, вставки, инверсии и т.п.), то рекомбинанты унаследуют нуклеотидную последовательность
партнера, у которого разрыва не происходило. Этот механизм объясняет многие случаи генной конверсии, особенно те, в которых протяженная последовательность одного дуплекса замещается соответствующей, но отличающейся последовательностью другого
дуплекса.
Нереципрокная общая рекомбинация используется и при репарации некоторых повреждений ДНК. Например, если тиминовые димеры не были удалены из УФ-облученной ДНК до того, как к ним подошла репликативная вилка, то синтез комплементарной цепи в этом участке не может быть завершен. Поскольку тиминовые димеры, находящиеся напротив бреши, не могут быть вы-
щеплены, остается один путь для спасения хроматиды – использовать генетическую информацию гомологичной сестринской хроматиды и заполнить брешь. Для этого применяется такой же механизм, как для репарации брешей.
в.
Ферменты, участвующие в общей рекомбинации.
В общей рекомбинации участвуют два специфических фермента и еще несколько ферментов, катализирующих также процессы репликации и репарации ДНК. Энзимология общей рекомбинации изучена только для некоторых прокариотических организмов, в частности E. coli и ее фагов. Один из специфических ферментов, необходимых для успешной гомологичной рекомбинации, называется recА-белком.
Он катализирует обмен одиночными цепями, используя энергию гидролиза АТР до ADP и неорганического фосфата. RecA-зависимое внедрение одноцепочечных ДНК в дуплекс – первый этап рекомбинационного процесса в рамках обеих схем Холлидея и механизма с образованием двухцепочечных разрывов. Второй фермент, состоящий из трех отдельных субъединиц (В, С и D) и поэтому называемый recBCD-нуклеазой, обладает эндо- и экзонуклеазной, а также геликазной активностями. Механизм его действия до конца не установлен, однако известно, что
recBCD-нуклеаза индуцирует разрывы в дуплексной ДНК и благодаря присущей ей геликазной активности вместе с recА инициирует рекомбинационный.
Идентифицирован также фермент, разрезающий узлы в структурах Холлидея; при его участии образуются липкие концы, соединяемые лигазой. В общей рекомбинации участвуют также геликазы и белки, связывающиеся с одноцепочечной ДНК
(SSB; от англ. single strand binding); оба они необходимы для обеспечения процесса миграции ветви.
Как известно, перемещению цепей во время миграции ветви способствует Pol I, а в воссоединенииразорванных цепей участвует ДНК-лигаза. Для снятия топологических ограничений при раскручивании спирали и для раcпутывания перекрученных структур, по-видимому, нужны топоизомераза типа I и, возможно, гираза.
Гомологичная рекомбинация в репарации ДНК
Быстро делящиеся бактериальные клетки, содержащие несколько репликонов, образованных недореплицированными хромосомами, более устойчивы к действию ионизирующей радиации, которая индуцирует двухцепочечные разрывы ДНК, чем клетки с небольшим числом репликонов, находящиеся в стационарной фазе.
Гаплоидные клетки дрожжей в фазе G1 перед началом синтеза ДНК чрезвычайно чувствительны к действию ионизирующей радиации, тогда как те же клетки в фазе G2 перед митозом так же устойчивы к ионизирующему излучению, как и диплоидные клетки.
Эти факты указывают на то, что для эффективного исправления
повреждений, вызываемых ионизирующей радиацией, необходимо одновременное присутствие в клетке двух гомологичных молекул ДНК.
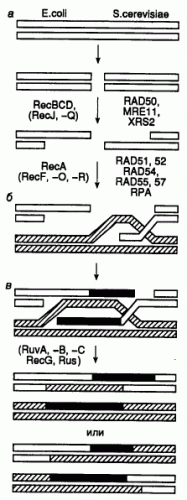 рис.1 Одна из моделей объясняющих репарацию двуцепочечных разрывов.
рис.1 Одна из моделей объясняющих репарацию двуцепочечных разрывов.
Процесс репарации условно разделяется на три этапа:
1. Пресинаптическая фаза - происходит внесение двухцепочечного разрыва в ДНК или, при его наличии, сразу осуществляется нуклеазное расщепление концов разрыва. В создании одноцепочечных 3’-OH-выступающих концов ДНК в месте разрыва принимает участие белок RecBCD, который обладает как геликазной, так и экзонуклеазной активностями. RecBCD расплетает двухцепочечную молекулу ДНК в месте разрыва и гидролизует одну из цепей в направлении 5’>3’, оставляя выступающий одноцепочечный участок.
2. Синаптическая фаза - происходит синапсис гомологичных участков двух молекул ДНК с вхождением комплементарного
одноцепочечного участка в ДНК-дуплекс и последующим репаративным синтезом ДНК. Поиск гомологичных участков и обмен цепями, необходимые для рекомбинации, происходят с участием белка RecA.
3. Постсинаптическая фаза - образовавшиеся структуры Холидея разделяются с помощью белков RuvA, -B и -C, RecG, а также белков SOS-системы репарации (RecN, UvrD, RecF и RecJ). Похожие механизмы используются клетками для рекомбинационной репарации одноцепочечных брешей, остающихся в молекулах ДНК из-за блокировки репликативного синтеза ДНК модифицированными нуклеотидами.
Многие продукты генов E. coli и дрожжей, участвующие в рекомбинационной репарации повреждений ДНК, имеют гомологи у животных и человека. Отличительной особенностью эукариотической рекомбинации и репарации является вхождение соответствующих белков в многочисленные белковые комплексы, в частности транскриптосомы и реплисомы, что
указывает на их важную роль в матричном биосинтезе нуклеиновых кислот эукариотических клеток.
Сайт-специфическая рекомбинация
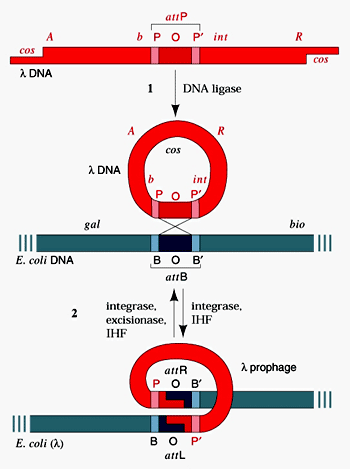 Механизм сайт-специфической рекомбинации
Механизм сайт-специфической рекомбинации
Сайт-специфическая рекомбинация происходит между специфическими сегментами дуплексов ДНК, не имеющими протяженных гомологичных участков. Характерным примером такой рекомбинации служит встраивание кольцевой ДНК фага λ в хромосому Е. coli и ее обратное выщепление. Рекомбинация происходит в пределах специфической нуклеотидной последовательности ДНК фага λ (attP-сайт) и уникальной последовательности ДНК Е. coli (аttВ-сайт). Нуклеотидные последовательности attP- и attВ-сайтов совершенно различны, хотя имеют общее ядро (О) протяженностью в 15 нуклеотидных пар. AttP (POP') простирается на 150 нуклеотидов влево (Р) и на 75 нуклеотидов вправо (Р') от общего ядра, a attB (BOB') – это сегмент длиной всего около 25 нуклеотидов, включая и ядро. Поскольку нуклеотидные последовательности, фланкирующие attP- и attВ-сайты слева (attL) и справа (attR), для этих сайтов различаются, механизм рекомбинационного выщепления ДНК фага λ из ДНК Е. coli должен отличаться от механизма их рекомбинационной интеграции. И действительно, для рекомбинации между attL и attR при исключении фаговой ДНК помимо белка Int необходимы фаговый белок xis и клеточный белок HF. Процесс рекомбинационного выщепления, по-видимому, имеет некоторое сходство с процессом интеграции, но роль указанных трех белков, особенно белка xis, все еще изучается.
Случайная рекомбинация
Негомологичная рекомбинация. Рекомбинация между негомологичными нуклеотидными последовательностями происходит в клетках прокариот и дрожжей достаточно редко, а в клетках млекопитающих – весьма часто. К негомологичной рекомбинации можно отнести процесс случайного встраивания вирусной или плазмидной ДНК в ДНК клеток животных, в результате чего в реплицирующихся
геномах паповавирусов появляется множество делеций и дупликаций. Концы разорванной ДНК могут соединиться, даже если они негомологичны. В некоторых случаях рекомбинация происходит между последовательностями, содержащими несколько гомологичных пар оснований, или между короткими частично гомологичными участками. Но, как правило, рекомбинирующие сегменты не имеют гомоло-
гичных последовательностей.