Фотореактивация
Абсорбция энергии УФ излучения молекулами ДНК приводит к образованию различных типов повреждений. Хотя одно- и двуцепочечные разрывы, а также ДНК-белковые сшивки могут возникать, большая часть индуцированных УФ-излучением повреждений приходится на модификацию азотистых оснований, с образованием циклобутан пиримидиновых димеров (CPD) и пиримидин-пиримидоновых фотопродуктов (6-4PP), как наиболее часто встречающихся типов фотоповреждений.
Пиримидиновые димеры являются ингибиторами и для репликации, и для транскрипции, что замедляет рост и приводит к мутагенезу в процессе репликации ДНК, если такие повреждения остаются неотрепарированными.
Для удаления индуцированных светом повреждений в ДНК у многих организмов применяются ферменты, специфично связывающиеся с CPD (CPD-фотолиаза) или с 6-4PP (6-4PP-фотолиазы) и исправляющие эти повреждения. CPD-фотолиазы обнаружены в бактериях, грибах, растениях, беспозвоночных и во многих позвоночных, 6-4PP-фотолиазы обнаружены, пока, только в Drosophila, тутовом шелкопряде, Xenopus laevis и в гремучих змеях, но не у Escherichia coli или дрожжей. У людей не обнаружено фотолиаз. Фотолиазы содержат FAD как каталитический кофактор и дополнительный хромофор в качестве светособирающей антенны.
Дополнительные хромофоры – это или 5,10-метенилтетрагидрофолат (MTHF), или 8-гидрокси-5-деазорибофлавин (8-HDF), с максимумами поглощений на длинах волн 380 и 440 нм, соответственно. Кристаллические структуры CPD-фотолиаз E.coli и Anacystis nidulans подтверждают, что для связывания с ДНК ферменты поворачивают пиримидиновый димер из дуплекса в углубление, содержащее каталитический кофактор. Затем циклобутановое кольцо расщепляется в ходе переноса, индуцированного светом электрона. CPD-фотолиазы селективно распознают CPD, подобно ДНК-связывающим белкам. Белый свет или UV-B-излучение индуцируют экспрессию CPD-фотолиаз. В отличие от CPD-фотолиаз, 6-4PP-фотолиаза стабильно экспрессируется и не регулируется ни белым светом, ни UV-B-излучением.
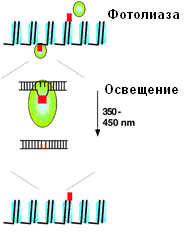
Схематичное изображение фотореактивации в хроматине. Октамеры гитонов голубого цвета, ДНК - черного. Фотолиаза связывается с циклобутан-пиримидиновыми димерами (CPD), поворачивает пиримидиновый димер и регенерирует природные пиримидины в ходе, зависимой от освещения, реакции. Фотолиаза предпочтительно репарирует CPD в линкетной ДНК. Репарация в нуклеосомах замедлена и, предположительно, облегчается динамическими свойствами нуклеосом, перемещающих повреждения ДНК в область линкерной ДНК.
Класс CDP-специфичных фотолиаз из микроорганизмов, определенный как класс I фотолиаз, был первым охарактеризованным представителем семейства фотолиаз. Близкородственный класс фотолиаз специфичных к 6-4-фотопродуктам был обнаружен недавно, представители этого семейства были найдены в Drosophila melanogaster, Xenopus laevis и Arabidopsis thaliana. Криптохромы, являющиеся фоторецепторами на фиолетовую часть светового спектра обнаруженные в растениях и других организмах, также являются близкородственными классу I фотолиаз.
Более дальнородственным семейством CPD-фотолиаз, названное классом II фотолиаз было идентифицировано в ряде видов, включая животных, Archaebacterium, Eubacterium и высших растений. Было показано, что все охарактеризованные фотолиазы содержат восстановленный FAD и большинство содержат вторичные хромофоры в зависимости от вида либо MTHF, либо 8-HDF. Подобный механизм реакции был предложен для обоих классов CPD-фотолиаз. Хромофор MTHF или 8-HDF подобен антенне, которая абсорбирует фиолетовый свет и расходует поглощенную энергию на регенерацию FADH-.
Состав кофактора растительной фотолиазы не до конца исследован, хотя, недавно было показано, что CPD-фотолиазы из Arabidopsis содержавшие только FADH обладали ферментативной активностью.
» Fritz Thoma, Light and dark in chromatin repair: repair of UV-induced DNA lesions by photolyase and nucleotide excision repair, Institut fur Zellbiologie, ETH-Zurich, Honggerberg, CH-8093 Zurich, Switzerland
» Characterization of Arabidopsis photolyase enzymes and analysis of their role in protection from ultraviolet-B radiation, Wanda M. Waterworth 1, Qing Jiang, Christopher E. West, M. Nikaido and Clifford M. Bray
