Гистоны
ГИСТОНЫ
Гистоны - белки образующие комплекс связывающийся с ДНК и участвующий в сворачивании ДНК - фолдинге и регуляции экспрессии.
Характеристика гистонов
| гистон | аминокислот | N-плечо | C-плечо |
| H3 | 135 | 41 | 25 |
| H4 | 102 | 32 | - |
| H2A | 129 | 24 | 16 |
| H2B | 125 | 30 | 23 |
| H1 |
Выделяют 5 фракций гистонов
| Фракция | Лизин | Аргинин | лиз./арг | осн.АК/кис.АК | Мол. вес (Да) |
| Н1 (очень богатая лизином) | 29% | 1% | >20 | 5.4 | 23000 |
| Н2В (умеренно богатая лиз) | 16% | 6% | ~2.5 | 1.7 | 13774 |
| Н2А (умеренно богатая лиз и арг) | 11% | 9% | ~1 | 1.4 | 13960 |
| Н4 (богатая арг и гли) | 11% | 14% | ~0.8 | 2.5 | 11282 |
| Н3 (очень богатая арг); есть цис, а в других – нет | 10% | 13% | ~0.7 | 1.8 | 15348 |
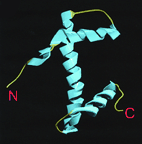
рис.1 Общая структура для гистонов H2A, H2B, H3, H4. Три центральные а-спирали образующие фолд домен и свободные концевые участки подвергаемые различным модификациям (см. обзор Модификации гистонов)
Гистоновые гены (Сингер Гены и геномы)
| вид | группа гистоновых генов | кластер, тпн | число копий |
| Дрожжи Sc | ←H2A→H2B ←H3→H4 |
6 и 13 | 2 2 |
| Dm | ←H3→H4←H2A→H2B←H1 | 5 | 100 |
| Морской еж S.purpuratus | →H1→H4→H2B→H3→H2A рассеянные, нек образ пары | 6-7 | 500 ранние 10 поздние |
| Тритон N.viridescens | ←H4←H2A→H2B←H3←H1 | 9 | 700 |
| Xenopus | H3-H4-H2A-H2B-H1B-H3-H4 →H3→H4←H2A→H2B |
16 6 |
25 |
| Курица | ←H3→H2A←H4-H1←H2A→H2B H2A-H4-H2A-H2B H3-H4 H5 (вместо Н1 в эритроцитах) |
14 >10 >10 |
10 1 |
| Человек | H3-H4-H4-H3-H2A-H2B H4-H3-H1-H2B-H2A →H2A→H2B←H4 |
20 15 6 |
10-20 5 неизвестно |
Большинство гистоновых генов (гг) синтезируется в S-фазе клеточного цикла. Гг объединены в кластеры но транскрибируются отдельно. У птиц и млекопит рассеяны по геному. Большинство реплицирующихся гг лишены интронов, у мРНК нет 3'-poly(A)-конца.
Морской еж: на ранних стадиях развития функционируют специфические гг, ответственные за быстрый синтез гистонов. После образования бластулы начинается синтез других гг.
Dm: гг находятся во второй х-ме. В эмбриогенезе, возможно, гистоны образуются с альтернативных гг.
Гистон H1
Гистон H1 соединяется с нуклеосомой ДНК и участвует в образовании 30 нм фибриллы. Присутствует у животных, растений и грибов. У некоторых архебактерий имеются схожие аналоги.
Гистон H2A
Гистон H2B
Гистон H3
Гистон H4
Аналоги гистонов
| гистон | Hs, Mm | Dm | Sc |
| H2A | H2AX H2A1 H2A.Z H2ABbd macroH2A |
H2Av
H2Av |
Htz1 |
| H2B | - | - | - |
| H3 | H3.3 Cid |
||
| H4 | - | - | - |
| H1 | H1.1 H1.2 H1.3 H1.4 H1.5 H10 H1t H1oo |
Hho1p |
аналоги H2A
H2AX - играет роль в репарации ДНК, SQEY мотиф Р в сайтах где ДНК повреждена и собирает репарирующие белки.
H2A.X фосфорилируется во время апоптоза, что приводит к разрушению ДНК, участвует по крайней мере в одном пути репарации у мышей (см. обзор Репарация ДНК). (Smith et al., 2002)
H2A1 - инактивация Х-х-мы и дозовая компенсация у млекопит.
H2A.Z (Htz1 у дрожжей) существенный белок дрозофилы, мышей и Sc. вовлеченный в активацию и подавление транскрипции. (Swaminathan 2005)
H2Av Dm пресутствует в хромоцентре гетерохроматина и связан с транскрибируемыми и нетранскрибируемыми генами в дисках и междисков политенной хромосомы. His2Av схож генетически с PcG генами и мутации в His2Av подавляют PEV, предполагает что выриант гистона необходим для эухроматинового сайленсинга и образования гетерохроматина. His2Av мутанты обнаруживают уменьшение ацетилирования гистона H4 лизина Lys 12, увеличивается метилирование гистона H3 Lys 9, и уменьшается соединение HP1 с прецентромерными регионами. H2Av накопление или ацетилирование H4K12 не затрагивается мутациями в Su(var)3-9 или Su(var)2-5. В каскаде ведущему к установлению гетерохроматина и присоединению варианта H2Av обеспечивается H4K12 ацетилированием, являющемся необходимым шагом для метилирования H3K9 и просоединения HP1. (Swaminathan 2005)
H2ABbd (Barr body deficient) вариантгистона с 48% идентичностью к гистону H2A обнаружен в 2001 г. H2ABbd короче чем обычный H2A, и содержит последовательнотсь из шести аргининов на конце и имеет нестандартный для всех H2A С-конец. Аминокислотная последоватльность фолд домена гистона H2ABbd существенно отличается от H2A
macroH2A инактивация Х-хромосомы у млекопитающих. MacroH2A участвует в присоединении транскрипционного фактора и SWI/SNF нуклеосомном ремоделингею. (Gautier, 2004)
аналоги Н2В не обнаружены
аналоги Н3
(Dm) H3.3 - в активном хроматине, Cid - компонент прицентромерного гетерохроматина. Перемещение H3 только при репликации, H3.3, Cid во всем кл цикле | перемещение H3.3 не согласуется с репликацией | H3 отличается от H3.3 на 4 аминокислоты.
зависимости м-у увеличением уровня ацетилирования гистонов и повышения уровня экспрессии (Smith, 2002)
Гистон H3.3 вовлечен в репликацию ДНК и может лужить маркером роматиновых регионов высокой транскрипционной активности.(Smith, 2002)
Гены гистонов имеют 3’ нетранскрибируемый район вместо poly(A)-конца. Dm: один ген кодирует Сid и два Н3.3 вне S фазы
Н3.3 и Н3 встраиваются во время репликации, Н3.3 и Cid могут встраиваться не зависимо от репликации. Н3-подобный центромерный гистон СеnН3 наблюдается у разных животных, грибов и растений. Н3.3-подобный гистон в активном макронуклеусе Ciliate. Варианты Н3 занимают малую часть хроматина и их свойства обычно не наблюдаются.(Ahmad, 2002)
Сначало собирается (H3-H4)2 – тетрамер и затем добавляются два H2A-H2B димера. Новые гистоны собираются, добавляется H1 и модифицируются гистоновые плечи. (Ahmad, 2002)
PCNA – proliferating cell nuclear antigene
аналоги Н4
аналоги Н1
H1.1-H1.5,H10,H1t - субтипы у млекопит. Гистон H5 в придшеств эритроцитов курицы
H1oo был обнаружен в ооцитах мыши. H5 встречается только у амфибий и рептилий, где он обнаружен в изобилии в транскрипционно неактивных ядрах эритроцитов. Ядро зрелых эритроцитов почти полностью гетерохроматиновое, что позволяет поддерживать малый объем хроматина. Экспрессия гистона H5 коррелирует с прекращением работы RNA-полимеразы II. Предполагается, что гистон H5 участвует в инактивации генома и является частью программы конечной дифференциации эритроцитов. Гистон H1.0 гомолог млекопитающих близок по структуре к H5 чем к H1. Исследования показали что его колличество увеличивается в клетках закончивших дифференцировку. Оверэкспрессия гистона H1.0 способна замедлить прохождение клеточного цикла и подавить экспрессию. H1.0 может конкурировать с одинаковыми последовательностями хроматина с RNA-полимеразой II. H1 состоит из центрального глобулярного домена фланкированного по краям хвостовыми доменами. Наибольшее различие между вариантами заключается в различии их хвостовых доменов. N-конец не требуется для индукции высокоорганизованных структур. С-конец необходим для сворачивания хроматина, но не существеннен в защите от нуклеаз связанного с присоединением гистона H1. Точечная мутация и делеционные эксперименты с участием гистона H1.1 показали что одиночное фосфорилирование cdk в пределах С-концевого домена может отвечать за сборку всей гистоновой молекулыe. (Th’ng 2005)
Экспрессия гистоновых генов и сборка нуклеосом
Во время репликации материнские гистоны случайно распределяются по обеим цепям ДНК. Вновь синтезированные гистоны дополняют нуклеосомы. Разделение нуклеосом и добавление новых гистонов, степень репликации и синтез гистонов четко координируется.
Во время S-фазы происходит синтез ДНК, синтез гистонов и образование нуклеосом. Эти три события начинаются одновременно в начале S-фазы. Если подавлять синтез ДНК ингибиторами, то подавляется и синтез гистонов. Механизм точного контроля не известен.
При ингибировании синтеза гистонов или сборки хроматина также происходит ингибирование синтеза ДНК
Человеческий белок HIRA (histone regulator A) ответственен за контроль синтеза гистонов. Hir1p, Hir2p -репрессоры транскрипции гистонов Sc.В фибробластах Hs HIRA колокализуется с HDAC4. HIRA - субстрат циклинаА или E/cdk2 в S-фазе. Фосфорилирование HIRA циклином/cdk2 регулирует экспрессию гистонов во время клеточного цикла. SLBP - белок стабилизирующий гистоновую мРНК.
CAF1 (Chromatin Assembly Factor) - белковый комплекс из 3 субъед: 150, 60, 50 кДа связывает вновь образ гистоны Н3 и Н4 с ДНК с образованием тетрамера, содержит p150, p60 и p48. Активность CAF1 зависит от связи p150CAF1 с p60CAF1 и с вспомогательными факторами репликации, PCNA (Adams, 2001 scientific report) Вновь синтезируемые H3 и H4 связываются первыми двумя субъединицами (150, 60), из которых пид 150 кДа обладает заряженным доменом, а др содержит в своем составе WD-повтор(TrpAsn). Затем к нуклеосоме добавляются H2A и H2B так же при участии шаперонов с образованием октамера. Шапероны способны запасать гистоны, перемещать к ядру, обменивать гистоны на ДНК, укладывать гистоны в нуклеосому.
Транскрипция ДНК в нуклеосоме подавляется Swi-Snf комплексом.
Гистоны прокариот
Нуклеоид прокариот представляет ~100 петель. Эти петли конденсированы основными протеинами и другими плохо изученными факторами. HU белки (Hu-1 и Hu2) ~18кДа существуют как гетеродимеры. H-NS белок 16,5 кДа формирует димер связывающий ДНК. Имеется ~20000 H-NS молекул, что составляет один димер на ~400пн ДНК.
У аналогов коровых гистонов архебактерий отсутствуют 'хвосты'.
- Drlica K, Rouviere-Yaniv J. (1087) Histonelike proteins of bacteria. Microbiol Rev. 51(3):301-19. Adams, 2001
- Downs, 2003
- H. KASINSKY, J. LEWIS, J. DACKS, J. AUSIO (2001) Origin of H1 linker histones. The FASEB Journal;15:34-42
- C. M. Smith et al., (2002). Proc Natl Acad Sci U S A Ahmad, 2002
- Th'ng JP, Sung R, Ye M, Hendzel MJ. (2005) H1 family histones in the nucleus. Control of binding and localization by the C-terminal domain.
- J Biol Chem. Jul 29;280(30):27809-14. Epub 2005 May 23
- Gautier Histone variant H2ABbd confers lower stability to the nucleosome, 2004
- Chadwick & Willard, 2001
- Swaminathan J, Baxter EM, Corces VG. (2005) The role of histone H2Av variant replacement and histone H4 acetylation in the establishment of Drosophila heterochromatin. Genes Dev. Jan 1;19(1):65-76.